Tlenek żelaza

- 4761
- 666
- Marianna Czarnecki
 Tlenek żelaza jest chemicznym związkiem między żelazem a tlenem
Tlenek żelaza jest chemicznym związkiem między żelazem a tlenem Co to jest tlenek żelaza?
On tlenek żelaza Jest to dowolne związki utworzone między żelazem a tlenem. Charakteryzują się, że są jonowe i krystaliczne i leżą rozproszone w wyniku erozji ich minerałów, składania gleb, masy roślin, a nawet wnętrza żywych organizmów.
Jest to jedna z rodzin związków, które dominują w skorupie Ziemi. Do tej pory znane są tlenki żelaza, większość z nich ma naturalne pochodzenie i inne syntetyzowane w ekstremalnych warunkach ciśnienia lub temperatury.
Na górnym obrazie pokazano część proszku tlenku żelaza. Jego charakterystyczny czerwony kolor obejmuje żelazo kilku elementów architektonicznych w tak zwanych rdzy. Podobnie jest obserwowany na zboczach, górach lub glebach, zmieszanych z wieloma innymi minerałami, takimi jak żółty pył Goethita (α-feooh).
Najbardziej znane tlenki żelaza są hematytu (α-FE2ALBO3) i Maghemita (ϒ-faith2ALBO3), oba polimorfy tlenku żelazowego; I nie tylko magnetyt (wiara3ALBO4).
Ich struktury polimorficzne i duży obszar powierzchowny są wytwarzane przez interesujące materiały, takie jak sorbenty lub do syntezy nanocząstek o szerokich zastosowaniach.
Struktura tlenków żelaza
Górny obraz jest reprezentacją krystalicznej struktury brzydkiej, jednego z tlenków żelaza, w którym żelazo ma walencję +2. Czerwone kule odpowiadają anionom lub2-, Podczas gdy żółty do wiary kationów2+.
Zauważ, że każda wiara2+ jest otoczony sześcioma lub2-, tworzenie oktaedralnej jednostki koordynacji.
Dlatego brzydka struktura może „rozpadać się” w brzydkich jednostkach6, Gdzie centralnym atomem jest wiara2+. W przypadku oksihydroksydów lub wodorotlenków, jednostka oktaedryczna jest brzydka3(OH)3.
Może ci służyć: nadtlenek wapnia (CAO2): właściwości, ryzyko i zastosowaniaW niektórych strukturach zamiast oktaedronu istnieją jednostki czworościenne, brzydkie4. Z tego powodu tlenki żelaza są zwykle reprezentowane o okt. Lub tetrahedrze z centrami żelaza.
Struktury tlenków żelaza zależą od warunków ciśnienia lub temperatury, od stosunku wiary/lub , +4).
Ogólnie rzecz biorąc, nieporęczne aniony lub2- Dopasowują formowanie arkuszy, których dziury gospodarzem kationów wiary2+ lub wiara3+. Zatem istnieją tlenki (takie jak magnetyt), które mają żelazo z obiema wartościami.
Wielopostaciowość
Tlenki żelaza mają polimorfizm, to znaczy różne struktury lub krystaliczne układy dla tego samego związku. Tlenek żelazowy, wiara2ALBO3, ma do czterech możliwych polimorfów. Hematyt, α-fe2ALBO3, Jest najbardziej stabilny ze wszystkich; a następnie Maghemita, ϒ-wieżowa2ALBO3, i dla syntetycznej β-wiary2ALBO3 i ε- wiara2ALBO3.
Wszystkie mają własne rodzaje struktur i systemów krystalicznych. Jednak proporcja 2: 3 pozostaje stała, więc są trzy aniony lub2- na każde dwa katia wiara3+.
Różnica polega na tym, jak znajdują się brzydkie jednostki oktaedryczne6 w kosmosie i jak się spotykają.
Linki strukturalne
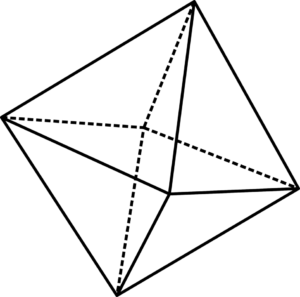 Brzydka jednostka ośmiadralna6
Brzydka jednostka ośmiadralna6 Brzydkie jednostki ośmiadralne6 można wizualizować za pomocą lepszego obrazu. W rogach Octaedro są OR2-, podczas gdy w jego centrum wiara2+ lub wiara3+(W przypadku wiary2ALBO3). Sposób, w jaki te oktahedry są ułożone w przestrzeni, ujawniają strukturę rdzy.
Wpływają jednak również na to, jak się powiązali. Na przykład dwa oktaedry mogą dołączyć do dwóch ich wierzchołków, które są reprezentowane z mostem tlenowym: Fe-O-fe. Podobnie Octahedra mogą przyłączyć się przez krawędzie (przylegające do siebie). Byłby wtedy reprezentowany z dwoma mostami tlenu: Fe- (o)2-Wiara.
Może ci służyć: tlenek chloru (v): właściwości, struktura, użyciaI wreszcie oktahedry mogą wchodzić w interakcje przez twarze. Zatem reprezentacja byłaby teraz z trzema mostami tlenu: Fe- (o)3-Wiara. Sposób, w jaki oktahedry są powiązane, odległości międzyjądrowe Fe -e różniłyby się, a zatem fizyczne właściwości tlenku.
Właściwości tlenków żelaza
Tlenek żelaza to związek o właściwościach magnetycznych. Mogą one być anty, żelazo lub ferrimagnetyczne i zależeć od wartościowości wiary i tego, jak kationowie oddziałują w stałym.
Ponieważ struktury stałe są bardzo zróżnicowane, podobnie jak ich właściwości fizyczne i chemiczne.
Na przykład polimorfy i hydraty wiary2ALBO3 Mają różne wartości punktów topnienia (które wahają się między 1.200 i 1.600 ° C) i gęstości. Mają jednak niewielką rozpuszczalność po wierze3+, Ta sama masa cząsteczkowa ma brązowe kolory i ledwo rozpuszczane w roztworach kwasowych.
Nomenklatura tlenków żelaza
IUPAC ustawia trzy sposoby nazwania tlenku żelaza. Te trzy są bardzo przydatne, choć w przypadku złożonych tlenków (takich jak wiara7ALBO9) Systematyka rządzi innymi ze względu na swoją prostotę.
Nomenklatura systematyczna
Uwzględniane są liczby tlenu i żelaza, nazywając je prefiksami mono-mono-, di-, tri- itp. Według tej nomenklatury wiara2ALBO3 jest nazywany: Tritlenek dałżelazo. I dla wiary7ALBO9 Nazywałby się: heptahierro nonksyd.
Nomenklatura zapasowa
Uwzględnia to Valencia del Hierro. Jeśli to wiara2+, Pisany jest tlenek żelaza ... i jego wartościowość z liczbami rzymskimi zamkniętymi w nawiasach. Za wiarę2ALBO3 Nazywa się: Iron Oxide (iii).
Może ci służyć: presja parowa: koncepcja, przykłady i ćwiczenia rozwiązaneZwróć uwagę na wiarę3+ Można to określić za pomocą sum algebraicznych. Tak2- Ma dwa ujemne ładunki, a są trzy, dodaj -6. Aby zneutralizować to -6 wymagają +6, ale są dwie wiary, aby musiały być podzielone przez dwa, +6/2 = +3:
2x (metal Valencia) + 3 (-2) = 0
Po prostu oczyszczenie wartościowości wiary w tlenku. Ale jeśli x nie jest liczbą całkowitą (jak w przypadku prawie wszystkich pozostałych tlenków), istnieje mieszanka wiary2+ i wiara3+.
Tradycyjna nomenklatura
Sufiks -ico jest przyznawany prefiksowi Ferr- Kiedy wiara ma Walencję +3, a -To gdy jej Walencja wynosi 2+. Zatem wiara2ALBO3 nazywa się: tlenek żelaza.
Zastosowanie tlenków żelaza
Nanocząstki
Tlenki żelaza mają wysoką energię krystalizacyjną, która pozwala tworzyć bardzo małe kryształy, ale o dużej powierzchni.
Z tego powodu bardzo interesują one dziedzinami nanotechnologii, w których projektują i syntetyzują nanocząstki tlenkowe (NP) do określonych celów:
- Jako katalizatory.
- Jako zbiornik narkotykowy lub geny w ciele.
- W projektowaniu powierzchni czuciowych dla różnych rodzajów biomolekuł: białka, cukry, tłuszcze.
- Aby przechowywać dane magnetyczne.
Pigmenty
Ponieważ niektóre tlenki są bardzo stabilne, służą do farbowania tekstyliów lub nadają jasne kolory powierzchni dowolnego materiału. Od mozaiki podłóg -czerwone, żółte i pomarańczowe (nawet zielone) obrazy -, tworzywa sztuczne, skóra po dzieła architektury.
Bibliografia
- Powiernicy Dartmouth College (18 marca 2004). Stochiometria tlenków żelaza. Zaczerpnięte z: Dartmouth.Edu
- Ryosuke Sinmyo i in. (8 września 2016 r.). Odkrycie Fe7ALBO9: Nowy tlenek żelaza o złożonej strukturze monoklinowej. Odzyskane z: natury.com
- M. Cornell, u. Schwertmann. Tlenki żelaza: struktura, właściwości, reakcja, występowanie i zastosowania [PDF]. Wiley-vch. Zaczerpnięte z: EPSC511.Wustl.Edu

