Tlenek boru (B2O3) Co to jest, struktura, właściwości, używa
- 1128
- 165
- Pani Gilbert Stolarczyk
On Tlenek boru o bezwodnik borowy jest nieorganicznym związkiem, którego wzór chemiczny wynosi B2ALBO3. Będąc elementami boru i tlenu blokowego p okresowego tabeli, a nawet więcej głów ich grup, różnica w elektroungalizacji między nimi nie jest bardzo wysoka; Dlatego oczekuje się, że B2ALBO3 być kowalencyjnym charakterem.
B2ALBO3 Przygotowuje się go przez rozpuszczenie boraksa w stężonym kwasie siarkowym wewnątrz piekarnika fuzji i w temperaturze 750ºC; Termicznie odwadniający kwas borowy, B (OH)3, w temperaturze około 300 ° C; lub może być również utworzone jako produkt reakcji Diborano (B2H6) Z tlenem.
Tlenek boro może mieć półprzewodnikowy lub krystaliczny szklany wygląd; Ten ostatni przez szlifowanie można uzyskać w postaci pyłu.
Chociaż nie wydaje się to na pierwszy rzut oka, B jest brane pod uwagę2ALBO3 jako jeden z najbardziej złożonych tlenków nieorganicznych; Nie tylko ze strukturalnego punktu widzenia, ale także ze względu na zmienne właściwości, które nabywają szkło i ceramika, do których są dodawane do matrycy.
Struktura tlenku boro
Unity Bo3
B2ALBO3 Jest to kowalencyjna substancja stała, więc teoretycznie nie istnieją w swojej strukturze jonowej B3+ ani2-, Ale linki B-O. Bor, według teorii linków Walencji (TEV), może tworzyć tylko trzy kowalencyjne linki; W tym przypadku trzy linki B-O. W wyniku tego oczekiwana geometria musi być trygonalna, bo3.
Cząsteczka BO3 To słabe elektrony, zwłaszcza atomy tlenu; Jednak kilka z nich może wchodzić w interakcje w celu dostarczenia wspomnianego niedoboru. Tak więc trójkąty bo3 Dołącza się do nich dzielenie mostu tlenu i są rozmieszczone w przestrzeni jako trójkątne wiersze z ich samolotami zorientowanymi na różne sposoby.
Może ci służyć: nienasycone rozwiązanieStruktura krystaliczna
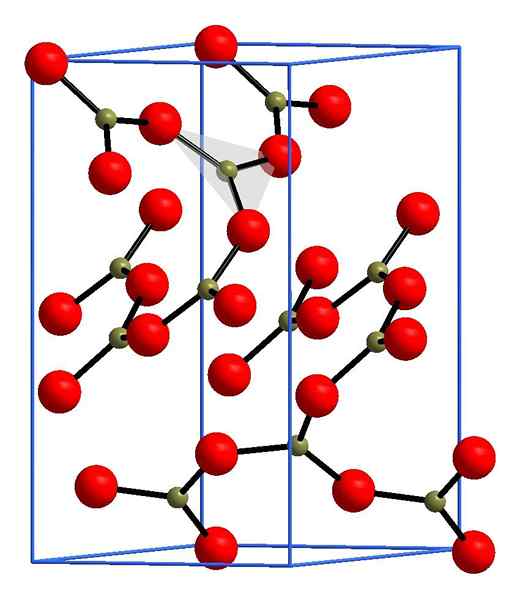
 Struktura tlenku boro. Andif1, Wikimedia Commons.
Struktura tlenku boro. Andif1, Wikimedia Commons. Na górnym obrazie przykład tych rzędów z trójkątnymi jednostkami Bo3. Jeśli jest to obserwowane ostrożnie, nie wszystkie twarze planów wskazują na czytelnika, ale na drugą stronę. Orientacje tych twarzy mogą być odpowiedzialne za definiowanie B2ALBO3 w pewnej temperaturze i ciśnieniu.
Kiedy te sieci mają długą wysokość strukturalną, jest to krystaliczna substancja stała, którą można zbudować z komórki jednostkowej. Tutaj mówi się, że b2ALBO3 Ma dwa krystaliczne polimorfy: α i β.
Α-B2ALBO3 Jest wytwarzany w ciśnieniu otoczenia (1 atm) i mówi się, że jest niestabilny kinetycznie; W rzeczywistości jest to jeden z powodów, dla których tlenek boru jest prawdopodobnie trudnym związkiem krystalizacyjnym.
Drugi polimorf, β-B2ALBO3, Wysokie ciśnienia są uzyskiwane w zakresie GPA; Dlatego jego gęstość musi być większa niż w przypadku α-B2ALBO3.
Struktura szklistej
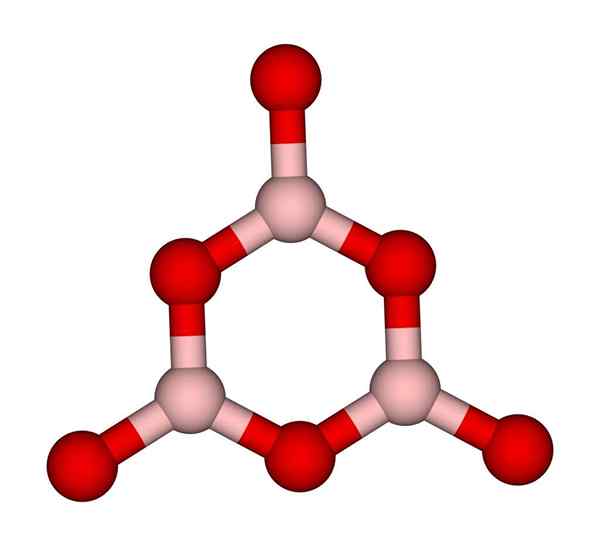 Pierścień boroksolu. CCOIL (Talk). Wikimedia Commons.
Pierścień boroksolu. CCOIL (Talk). Wikimedia Commons. BO Networks3 naturalnie mają tendencję do przyjmowania struktur amorficznych; Są to, które nie mają wzorca opisującego cząsteczki lub jony w stałym. Synteza B2ALBO3 Jego dominująca postać jest amorficzna, a nie krystaliczna; W poprawnych słowach: jest to solidniejsze szkliste niż krystaliczne.
Mówi się wtedy, że b2ALBO3 Jest szklistość lub amorficzna, gdy twoi chłopcy z Bo3 Są niechlujne. Nie tylko to, ale także zmieniają sposób, w jaki dołączają. Zamiast zamawiać w geometrii trygonalnej, kończy się pierścień boroksolu (obraz wyższy), aby stworzyć naukowców (obraz doskonały).
Może ci służyć: 20 przykładów energii chemicznejZwróć uwagę na oczywistą różnicę między jednostkami trójkątnymi i sześciokątnymi. Trójkątny charakterystyka b2ALBO3 krystaliczne i sześciokątne do B2ALBO3 szklisty. Innym sposobem odniesienia się do tej amorficznej fazy jest szkło borowe lub za pomocą wzoru: G-B2ALBO3 („G” pochodzi od słowa szklistego, po angielsku).
Zatem sieci G-B2ALBO3 Składają się z pierścieni boroksolu, a nie jednostek BO3. Jednak G-B2ALBO3 może krystalizować do α-B2ALBO3, co oznaczałoby interakcję pierścieni do trójkątów, a także określa osiągnięty stopień krystalizacji.
Nieruchomości
Wygląd fizyczny
Jest to bezbarwne i szkliste stałe. W swojej krystalicznej postaci jest biały.
Masa cząsteczkowa
69 6182 g/mol.
Smak
Nieco gorzki
Gęstość
-Krystaliczny: 2,46 g/ml.
-Szkliste: 1,80 g/ml.
Temperatura topnienia
Nie ma w pełni zdefiniowanego punktu fuzyjnego, ponieważ zależy to od krystalicznego lub szklistego. Czysto krystaliczna postać topi się do 450ºC; Jednak szklisty kształt topi się w zakresie temperatur, który obejmuje od 300 do 700ºC.
Punkt wrzenia
Ponownie zgłoszone wartości nie pasują do tej wartości. Najwyraźniej ciekł tlenek boru (stopiony z jego kryształów lub szkła) gotuje się w 1860ºC.
Stabilność
Musi być suchy, ponieważ pochłania wilgoć w celu przekształcenia w kwas borowy, B (OH)3.
Nomenklatura
Tlenek boro można nazwać na inne sposoby, na przykład:
-TRIOTOLENEK DIBORO (nomenklatura systematyczna).
-Tlenek boru (iii) (nomenklatura zapasowa).
-Tlenek borowy (tradycyjna nomenklatura).
Aplikacje
Niektóre zastosowania tlenku boru to:
Synteza Boro Trihalogenuros
Z b2ALBO3 może być zsyntetyzowane przez Trihalogenuros de Boro, Bx3 (X = f, cl y br). Związki te są kwasami Lewisa, a wraz z nimi można wprowadzić atomy boru do niektórych cząsteczek w celu uzyskania innych pochodnych o nowych właściwościach.
Może ci służyć: jony poliatomiczne: lista i ćwiczeniaŚrodek owadobójczy
Stała mieszanka z kwasem borowym, b2ALBO3-B (OH)3, reprezentuje formułę używaną jako domowy owadobój.
Rozpuszczalnik tlenków metali: tworzenie się szkła, ceramika i stopy boru
Ciekł tlenek boru jest zdolny do rozpuszczenia tlenków metali. Z tej powstałej mieszaniny, po schłodzeniu, uzyskane są ciała stałe złożone z boru i metali.
W zależności od kwoty B2ALBO3 Stosowane, a także technikę i rodzaj tlenku metalicznego, bogatą różnorodność szkła (borokrzemian), ceramikę (azotki i węgliki boru) i stopy można uzyskać (jeśli zastosowano tylko metale).
Zasadniczo szkło lub ceramika nabiera większej odporności i siły, a także większą trwałość. W przypadku szkła są one używane do soczewek optycznych i teleskopowych oraz do urządzeń elektronicznych.
Spoiwo
W konstrukcji piekarników stalowych stosuje się oporne cegły z magnezem. W nich tlenek boru jest używany jako spoiwo, co pomaga utrzymać ich silnie zjednoczone.
Bibliografia
- Tlenek borowy. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Tlenek Borix. 20 Mule Team Borax. Odzyskany z: boraks.com

