Struktura, właściwości, zastosowania i ryzyko trietilaminy

- 2360
- 599
- Filip Augustyn
TrieThilamina Jest to związek organiczny, a ściślej alifatyczna amina, której wzór chemiczny wynosi N (CH2Ch3)3 lub netto3. Podobnie jak inne płynne aminy, przedstawia zapach podobny do zapachu amoniaku zmieszanego z rybami; Jego opary powodują żmudne i niebezpieczne manipuluj tą substancją bez odpowiedniego ekstraktora lub ubrania.
Oprócz odpowiednich wzorów, zwykle jest on skrócony do tego związku jako ASD; Może to jednak spowodować zamieszanie z innymi aminami, takimi jak trietanolamina, n (ETOH)3, lub tetraetilamonium, czwartorzędowa amina, netto4+.
 Szkielet trietyloaminy. Źródło: Mieszanki [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Szkielet trietyloaminy. Źródło: Mieszanki [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] Ze szkieletu (obrazu lepszego) można powiedzieć, że trietyloamina jest dość podobna do amoniaku; Podczas gdy drugi ma trzy hydrogeny, NH3, Pierwsza ma trzy grupy etylowe, n (ch2Ch3)3. Jego synteza rozpoczyna się od leczenia ciekłego amoniaku etanolem, występującym alkilacją.
Sieć3 Możesz utworzyć sól higroskopijną z HCL: chlorowodorek trietilaminy, netto3· HCl. Oprócz tego uczestniczy jako jednorodny katalizator w syntezie estrów i objadów, więc jest to niezbędny rozpuszczalnik w laboratoriach ekologicznych.
Ponadto, wraz z innymi odczynnikami, pozwala na utlenianie alkoholi pierwotnych i wtórnych odpowiednio do aldehydów i ketonów. Podobnie jak amoniak jest podstawą, a zatem może tworzyć sole organiczne poprzez reakcje neutralizacyjne.
[TOC]
Struktura trietyloaminy
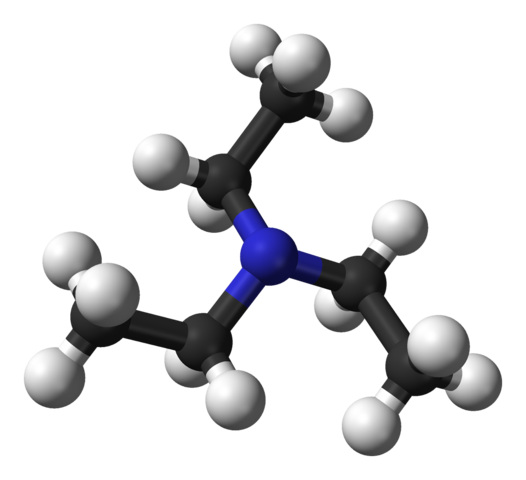 Struktura trietyloaminy. Źródło: Benjah-BMM27 [domena publiczna].
Struktura trietyloaminy. Źródło: Benjah-BMM27 [domena publiczna]. Górny obraz pokazuje strukturę trietyloaminy z modelem sfer i prętów. W środku cząsteczki atom azotu znajduje się, reprezentowany przez niebieskawą kulę; I powiązane z nim trzy grupy etylowe, takie jak małe gałęzie czarnych i czarnych kul.
Chociaż nie mają ich nagiego oka, na atom azotu istnieje kilka nieistotnych elektronów. Te dwa elektrony i trzy grupy -ch2Ch3 Doświadczają elektronicznych odpychania; Ale z drugiej strony przyczyniają się do zdefiniowania dipolowego momentu cząsteczki.
Może ci służyć: cykloalcanos: właściwości, reakcje, zastosowania, przykładyJednak taki moment dipolowy jest niższy niż, na przykład dietyloaminy, nhet2; A także brakuje mu możliwości tworzenia mostów wodorowych.
Wynika to z faktu, że w trietyloaminie nie ma wiązania N-H, w związku z czym obserwuje się niewielkie temperatury fuzji i wrzenia w porównaniu z innymi aminami, które oddziałują w taki sposób.
Chociaż istnieje niewielki moment dipolowy, siły dyspersji między grupami etylowymi cząsteczek netto nie można wykluczyć3 sąsiedzi. Dodając ten efekt, jest to uzasadnione, dlaczego, chociaż trietyloamina jest lotna, gotuje się około 89ºC, dzięki stosunkowo dużej masie cząsteczkowej.
Nieruchomości
Wygląd fizyczny
Bezbarwny płyn z nieprzyjemnym zapachem amoniaku i ryb.
Masa cząsteczkowa
101 193 g/mol.
Punkt wrzenia
89ºC.
Temperatura topnienia
-115ºC. Zwróć uwagę, jak słabe siły międzycząsteczkowe, które łączą cząsteczki trietyloaminy w ich stałym.
Gęstość
0,7255 g/ml.
Rozpuszczalność
Jest stosunkowo rozpuszczalny w wodzie, 5,5 g/100 g w 20ºC. Poniżej 18,7 °.
Oprócz „dogadywania się” z wodą, jest również rozpuszczalny w acetonie, benzenie, etanolu, eterze i parafinie.
Gęstość pary
3.49 w odniesieniu do powietrza.
Ciśnienie pary
57,07 mmHg w 25ºC.
Henry Constant
66 μmol/pa · kg.
punkt zapłonu
-15ºC.
Temperatura samo -kierunkowego
312ºC.
Pojemność cieplna
216,43 kJ/mol.
Ciepło spalania
10.248 limonki/g.
Ciepło parowe
34,84 kJ/mol.
Napięcie powierzchniowe
20,22 N/m A 25ºC.
Współczynnik załamania światła
1400 do 20ºC.
Breja
0,347 MPa · s w 25ºC.
Stała podstawowa
Trietilamina ma PKB równą 3,25.
Zasadowość
Zasadność tej aminy można wyrazić przez następujące równanie chemiczne:
Może ci służyć: syntetyczne polimeryInternet3 + Ha nhet3+ + DO-
Gdzie jest słaby gatunek kwasowy. Para NET3+DO- Tworzy to, co staje się trzeciorzędowym solą amonu.
Kwas koniugatu NET3+ Jest bardziej stabilny niż amon, NH4+, Ponieważ trzy grupy etylowe przekazują część swojej gęstości elektronicznej, aby zmniejszyć dodatnie obciążenie atomu azotu; Dlatego trietyloamina jest bardziej podstawowa niż amoniak (ale mniej podstawowy niż OH-).
Aplikacje
 Reakcje katalizowane przez trietyloaminę. Źródło: Tachymètre [domena publiczna].
Reakcje katalizowane przez trietyloaminę. Źródło: Tachymètre [domena publiczna]. W tym przypadku zasadność nukleofilność trietyloaminy stosuje się do katalizowania syntezy estru i amidów ze wspólnego podłoża: chlorku acylu, RCOCL (obraz wyższy).
Tutaj para wolnych od azotu atakuje grupę karbonylową, tworząc pośrednik; które kolejno jest atakowane przez alkohol lub aminę, aby utworzyć ester lub amida.
W pierwszym rzędzie obrazu mechanizm, który następuje po reakcji w celu wytworzenia estru, jest wizualizowany, podczas gdy drugi rząd odpowiada Amida. Zauważ, że w obu reakcjach występuje chlorowodorek trietyloaminy3· HCl, z którego odzyskuje się katalizator, aby rozpocząć kolejny cykl.
Polimery
Nukleofilność trietyloaminy jest również stosowana do dodania niektórych polimerów, gojenia się i dając im większe masy. Na przykład jest częścią syntezy żywic poliwęglowanych, pianek poliuretanowych i żywic epoksydowych.
Chromatografia
Jego zdalna amfifiliowość i zmienność pozwalają stosować sole pochodne jako odczynniki w chromatografii wymiany jonowej. Kolejnym domyślnym zastosowaniem trietyleleminy jest to, że można uzyskać z niej kilka soli trzeciorzędowych amin, takich jak wodorowęglan trietyloaminy, NET3HCO3 (lub TeaB).
Może ci służyć: kalorymetria: jakie badania i zastosowaniaProdukty komercyjne
Został zastosowany jako addytywny w formułowaniu papierosów i tytoniu, konserwantów żywności, podłóg, aromatu, pestycydów, barwników itp.
Ryzyko
Pary trietyloaminy są nie tylko nieprzyjemne, ale niebezpieczne, ponieważ mogą podrażniać nos, gardło i płuca, aby spowodować obrzęk płuc lub zapalenie oskrzeli. Podobnie, będąc gęstszym i ciężkim niż powietrze, pozostają na poziomie gruntu, przechodząc do możliwych źródeł ciepła, aby następnie eksplodować.
Pojemniki tej cieczy muszą być tak daleko od ognia, ponieważ stanowią one bezpośrednie niebezpieczeństwo wybuchu.
Ponadto kontakt z gatunkami lub odczynnikami, takimi jak: metale alkaliczne, kwas triclorooctowy, azotany, kwas azotowy (ponieważ tworzyłby nitrozoaminy, związki rakotwórcze), silne kwasy, nadtlenki i permangiany i permangiany.
Nie powinieneś dotykać aluminium, miedzi, cynku ani jego stopów, ponieważ ma ono możliwość ich korozji.
Jeśli chodzi o kontakt fizyczny, może powodować alergię i wysypkę skórną, jeśli ekspozycja jest ostra. Oprócz płuc może wpływać na wątrobę i nerki. A jeśli chodzi o kontakt z oka, powoduje podrażnienie, które mogłyby nawet uszkodzić oczy, jeśli nie zostaną one traktowane lub oczyszczone na czas.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Wikipedia. (2019). Trietyloamina. Źródło: w:.Wikipedia.org
- Merck. (2019). Trietyloamina. Odzyskany z: Sigmaaldrich.com
- National Center for Biotechnology Information. (2019). Trietyloamina. Baza danych Pubchem. CID = 8471. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Sieć danych toksykologii. (S.F.). Trietyloamina. Odzyskane z: toksnet.NLM.Nih.Gov
- Departament Zdrowia w New Jersey. (2010). Trietyloamina. Odzyskane z: NJ.Gov
- « 10 ciekawostek o średniowieczu, które Cię zaskoczą
- Struktura alkoholowa, właściwości, zastosowania i ryzyko izoamilico »

