Transaminacja
- 2003
- 575
- Estera Wojtkowiak
 Schemat reakcji aminotransferencji między aminokwasem a alfa-Zoacidem (źródło: alcibiades przez Wikimedia Commons)
Schemat reakcji aminotransferencji między aminokwasem a alfa-Zoacidem (źródło: alcibiades przez Wikimedia Commons) Co to jest transaminacja?
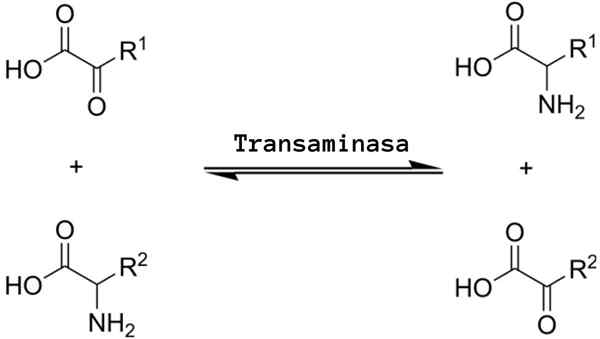
transaminacja Jest to rodzaj reakcji chemicznej, która działa w „redystrybucji” grup aminokwasowych, ponieważ otacza odwracalne procesy aminacji (dodanie grupy aminowej) i złamanego serca (eliminacja grupy aminowej), które są katalizowane przez określone enzymy znane jako transaminazy lub aminotransferazy.
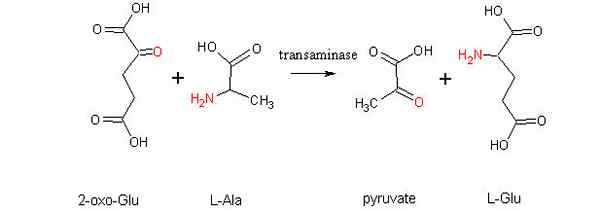
Ogólna reakcja transaminacji implikuje wymianę między aminokwasem a dowolnym α-Zo-stoatem, w którym wymiana grupy aminowej daje wersję ketoacidów pierwszego substratu aminokwasowego i wersji aminokwasowej pierwszego podłoża α-Z-Zo-chotoacidowego.
Grupa aminowa, która jest zwykle wymieniana, to amino „alfa”, to znaczy ta, która uczestniczy w tworzeniu połączeń peptydowych i która określa strukturę aminokwasów, chociaż reakcje obejmujące inne grupy aminowe występują w różnych pozycjach w różnych pozycjach w różnych pozycjach w różnych pozycjach w różnych pozycjach w różnych pozycjach w Różne pozycje mogą wystąpić w.
Z wyjątkiem lizyny, treminy, proliny i hydroksyproliny, wszystkie aminokwasy uczestniczą w reakcjach transaminacyjnych, chociaż w przypadku histydyny, seryny, metody i fenyloalaniny opisano transaminazy, ale ich trasy metaboliczne nie sugerują tego rodzaju reakcji reakcji.
Reakcje transaminacji między aminokwasami a α-cetoacidami zostały odkryte w 1937 r. Przez Braunsteina i Kritzmanna, a od tego czasu podlegały one intensywnym badaniom, ponieważ występują one w wielu tkaninach różnych organizmów i w różnych celach.
Na przykład u ludzi transaminazy są szeroko rozłożone w tkankach ciała i są szczególnie aktywne w tkance mięśni sercowej, w wątrobie, w tkance mięśni szkieletowej i w nerkach.
Mechanizm reakcji
Reakcje transaminacji oznaczają mniej więcej ten sam mechanizm. Jak wspomniano powyżej, reakcje te występują jako odwracalna wymiana grupy aminowej między aminokwasem a α-Zo-CID.
Może ci służyć: materiały ceramiczne: cechy, typy, przykładyReakcje te zależą od związku znanego jako pirydoksal fosforanowy, pochodna witaminy B6, która uczestniczy jako transporter grupy aminowej i który wiąże się z enzymami transaminazy poprzez tworzenie podstawy Schiffa między grupą aldehydową tej cząsteczki i ε-amino A. reszta lizyny w aktywnym miejscu enzymu.
Związek między pirydoksalem fosforanowym a resztą lizyny w miejscu aktywnym nie jest kowalencyjny, ale jest podawany poprzez oddziaływanie elektrostatyczne między dodatnim obciążeniem azotu w lizynie a obciążeniem ujemnym w grupie fosforanowej pirydoksal.
W trakcie reakcji aminokwas, który funkcjonuje jako substrat, wypiera grupę ε-aminową reszty lizyny w miejscu aktywnym, która uczestniczy w bazie Schiffa z pirydoksal.
Tymczasem para aminokwasowych elektronów węglowych jest usuwana i przenoszona do pierścienia pirydyny, który składa się z pirydoksal fosforanu (z ładunkiem dodatnim), a następnie „dostarczane” do α-ZID, który działa jako drugi podłoże substratowe.
W ten sposób fosforan pirydoksalny nie tylko uczestniczy w przenoszeniu lub transporcie aminokwasów między aminokwasami a α-chotoacidami, które są substratem transaminaz, ale także działa jako „zlew” elektronów, ułatwiając dysocjację wodór kwasu alfa.
Podsumowując, pierwszy substrat, aminokwas, przenosi swoją grupę aminową do pirydoksału fosforanu, skąd następnie jest przenoszony do drugiego substratu, α-Zo-cotoidu, tworzenia się w pośrednie fosforan.
Może ci służyć: chromatografia kolumnowaFunkcja transaminacji
Enzymy transaminazy są ogólnie występujące w cytosolu i mitochondriach i pracują w integracji różnych dróg metabolicznych.
Na przykład dehydrogenaza glutaminianowa w swojej odwrotnej reakcji może zamienić glutaminian w amon, NADH (lub NADPH) i α-zetoglutaran, które mogą wejść w cykl kwasów trikarboksylowych i funkcjonować w produkcji energii w produkcji energii.
Ten enzym, który znajduje się w matrycy mitochondrialnej, reprezentuje punkt rozgałęziony, który łączy aminokwasy z metabolizmem energii, tak że gdy komórka brakuje wystarczającej energii w postaci węglowodanów lub tłuszczów do funkcjonowania, może naprzemiennie wykorzystywać niektóre aminokwasy dla tego samego zamiar.
Tworzenie enzymu (dehydrogenazy glutaminianowej) podczas rozwoju mózgu jest niezbędne do kontroli detoksykacji amonu, ponieważ wykazano, że niektóre przypadki upośledzenia umysłowego mają związek z niską aktywnością tego, co prowadzi do gromadzenia się amonu, co jest szkodliwe dla zdrowia mózgu.
W niektórych reakcjach transaminacyjnych komórek wątroby można również zastosować do syntezy glukozy glukoneogenezy.
Glutamina jest przekształcana w glutaminian i amon przez enzym glutaminazy. Następnie glutaminian przekształca się w α-zetoglutaran, który wchodzi do cyklu Krebsa, a następnie do glukoneogenezy. Ten ostatni krok pojawia się dzięki Malo, jeden z produktów na trasie, jest transportowany poza mitochondria.
Ten wahadłów pozostawia α-cetoglutaran na łasce enzymu Málica, co czyni go pirogronianem. Dwie cząsteczki pirogronianu można przekształcić, a następnie cząsteczkę glukozy przez glukoneogenezę.
Może ci służyć: płaskie kolbę tłaPrzykłady
Najczęstsze reakcje transaminacji są związane z aminokwasami alaniny, kwasem glutaminowym i kwasem asparaginowym.
Niektóre enzymy aminotransferazy mogą, oprócz fosforanu pirydoksalnego, stosować pirogronian jako „koenzym”, podobnie jak w przypadku transaminazy glutaminian-pirevingan, który katalizuje następującą reakcję:
glutaminian + pirogronian ↔ alanina + α-celtoglutaran
Komórki mięśni zależą od tej reakcji w celu wytworzenia alaniny z pirogronianu i uzyskania energii przez cykl Krebsa za pomocą α-zetoglutoratu. W tych komórkach użycie alaniny jako źródła energii zależy od eliminacji grup aminowych jako jonów amonowych w wątrobie, przez cykl mocznika.
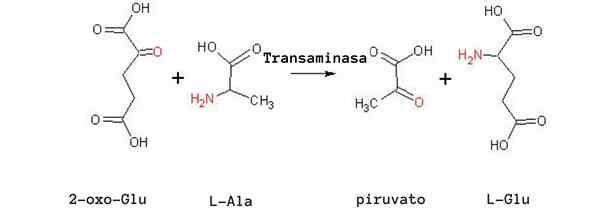 Reakcja transaminacji alaniny (Źródło: Tomas Drab [domena publiczna] za pośrednictwem Wikimedia Commons)
Reakcja transaminacji alaniny (Źródło: Tomas Drab [domena publiczna] za pośrednictwem Wikimedia Commons) Kolejną bardzo ważną reakcją transaminacyjną u różnych gatunków jest katalizowana przez enzym asparagan aminotransferazy:
L-spartato + α-ketoglutaran ↔ oksalacetan + l-glutaminian
Wreszcie, ale nie mniej więcej, reakcja transaminacji kwasu γ-aminobutyrynowego (GABA), aminokwas nieprotiałkowy dla ośrodkowego układu nerwowego, który działa jako hamujący neuroprzekaźnik. Reakcja jest katalizowana przez kwas γ-aminobutiryczny i jest mniej więcej w następujący sposób:
α-ketoglutaran + 4-aminobutanowy kwas ↔ glutaminian + sugerniczny półksiężyc
Symplicy suwanistyczne pół -użycie jest przekształcane w kwas bursztynowy przez reakcję utleniania, a ten ostatni może wejść do cyklu Krebsa w celu produkcji energii.

