Barwienie Ziehl-Neelsen
- 3888
- 294
- Eliasz Dubiel
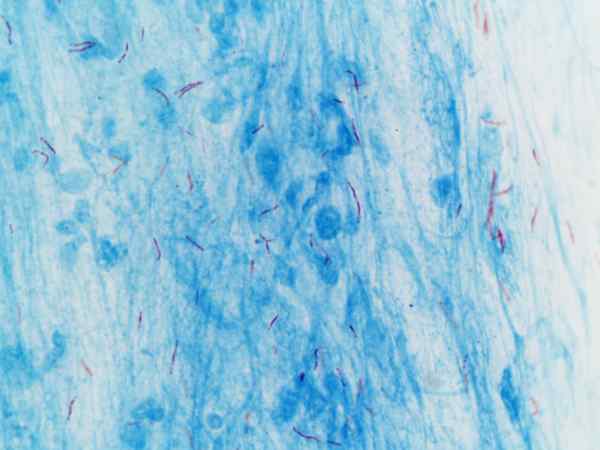
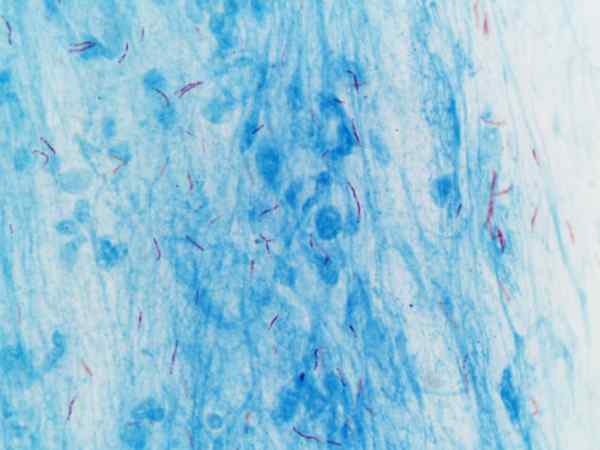 Mycobacterium tuberculosis wizualizowane z barwieniem Ziehl-Neelsen
Mycobacterium tuberculosis wizualizowane z barwieniem Ziehl-Neelsen Co to jest barwienie Ziehl-Neelsen?
Barwienie Ziehl-Neelsen W technice kolorowania w celu identyfikacji odpornych mikroorganizmów kwasowych alkoholu (AAR). Nazwa tej procedury mikrobiologii odnosi się do jej autorów: bakteriologa Franz Ziehl i patologa Friedricha Neelsen.
Ta technika jest różnicowym typem kolorów, co implikuje zastosowanie różnych barwników w celu stworzenia kontrastu między strukturami, które są pożądane do obserwacji, różnicowania, a następnie identyfikacji. Barwienie Ziehl-Neelsen służy do identyfikacji niektórych rodzajów mikroorganizmów.
Niektóre z tych mikroorganizmów to mykobakterie (na przykład, Prątek gruźlicy), Nocardias (na przykład, Nocardia sp.) i niektóre jednokomórkowe pasożyty (na przykład, Cryptosporidium parvum). Wiele bakterii można sklasyfikować za pomocą wspólnej techniki zwanej barwieniem gram.
Jednak niektóre grupy bakteryjne wymagają innych metod ich identyfikacji. Techniki takie jak barwienie Ziehl-Neelsen wymagają kombinacji ciepła z ciepłem, aby naprawić pierwszy w ścianie komórkowej.
Następnie pojawia się proces przebarwienia, który pozwala uzyskać dwa wyniki: oporność lub wrażliwość na przebarwienie kwasu i alkoholi.
Podstawa
Podstawą tej techniki barwienia opiera się na właściwościach ściany komórkowej tych mikroorganizmów. Ściana jest tworzona przez rodzaj kwasów tłuszczowych zwanych kwasami mikolowymi; Charakteryzują się prezentowaniem bardzo długich łańcuchów.
Kiedy kwasy tłuszczowe mają bardzo długie struktury, mogą one łatwiej zachować barwniki. Niektóre gatunki bakterii są bardzo trudne do barwienia przez barwienie gram, ze względu na wysoką zawartość kwasów mikolowych ze ściany komórkowej.
W barwieniu Ziehl-Neelsen stosuje się związek fenolowy karbolowy fuksyny, podstawowy barwnik. Ma to zdolność do interakcji z kwasami tłuszczowymi ściany komórkowej, która ma teksturę Cerosa w temperaturze pokojowej.
Może ci służyć: monosacharydyBarwienie karbolem fuksyny ulegnie poprawie w obecności ciepła, ponieważ woski topią się i cząsteczki kolorystyczne poruszają.
Kwas użyty później służy do przebarwienia komórek, które nie zostały barwione, ponieważ ich ściana nie była związana z barwnikiem; Dlatego siła kwasu kwaśnego jest w stanie wyeliminować barwnik kwasowy. Komórki, które opierają się tej przebarwienia, nazywane są opornością na kwas.
Barwnik wtórny
Po przebarwieniu próbki jest to kontrastowe z innym barwnikiem zwanym barwnikiem wtórnym. Mustileo Blue lub Malachite Green jest ogólnie używany.
Wtórny barwnik plami materiał tła, a zatem tworzy kontrast ze strukturami, które zostały barwione w pierwszym kroku. Tylko przebarwione komórki pochłaniają drugi barwnik (kontr-końcowy) i przyjmują ich kolor, podczas gdy komórki oporne na kwas zachowują czerwony kolor.
Ta procedura jest często stosowana do identyfikacji Prątek gruźlicy I Mycobacterium leprae, które nazywane są opornymi bachilami kwasowo-alkoholu.
Odczynniki
Pierwotny barwnik
Stosuje się 0,3 % karbol fuksyny (filtrowane). Ten barwnik przygotowuje się z mieszanki alkoholi: fenol etanolu (90 %) lub metanolu (95 %), aw tej mieszaninie 3 gramów podstawowej fuksyny rozpuszczają się.
Odkrywanie rozwiązania
W tym etapie można użyć 3 % roztworów kwasu alkoholowego lub 25 % kwasu siarkowego.
Kolorowanie wtórne (kontratak)
Najczęściej stosowanym barwnikiem do kontrastu w próbkach jest zwykle 0,3 % błękit metylenowy. Można jednak również zastosować inne, takie jak 0,5 % Malachite Green.
Może ci służyć: TiminaTechnika
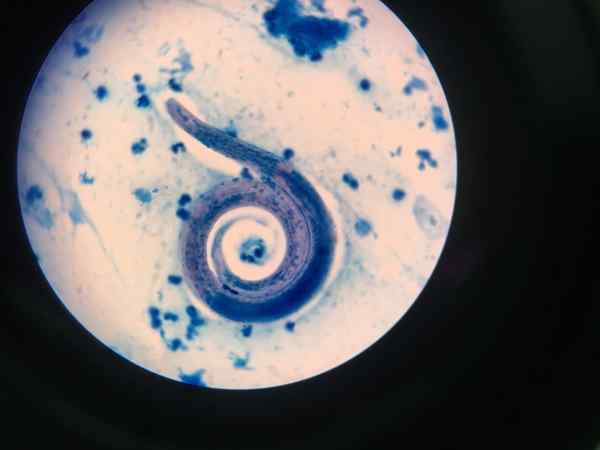 Nicień wyświetlany z Ziehl-Neelsen
Nicień wyświetlany z Ziehl-Neelsen Procedura barwienia opartego na kwasie
Przygotuj rozmaz bakteryjny
To przygotowanie odbywa się na czystym i suchym slajdzie, po sterylności środków ostrożności.
Suszenie Frovis
Niech such wyschł w temperaturze pokojowej.
Podgrzej próbkę
Próbka musi zostać podgrzewana, nakładając ogień do zjeżdżalni poniżej. Mocowanie z alkoholem można wykonać, gdy zapach nie będzie przygotowywany z plwocką (leczony podchlorynem sodu w celu wybielania) i jeśli nie zostanie natychmiast barwione.
M. gruźlica jest eliminowany wybielaczem i podczas procesu barwienia. Termiksacja nietraktowanej plwociny nie zabije M. gruźlica, Podczas gdy utrwalanie alkoholu jest bakteriobójstwem.
Przykryj plamę
Pejście jest pokryte roztworem karbolowym Fuchsin (podstawowa podstawowa kolorystyka).
Podgrzej plamę
Odbywa się to przez 5 minut. Należy zauważyć oddział pary (około 60 ° C). Ważne jest, aby nie przegrzać i unikać spalania próbki.
W odniesieniu do ogrzewania plamy powinieneś być bardzo ostrożnie podczas podgrzewania karbolu fuksyny, szczególnie jeśli barwienie jest przeprowadzane na tacy lub innym pojemniku, w którym zebrano wysoce łatwopalne chemikalia z poprzedniego barwienia.
Pod szkiełkami należy nakładać tylko mały płomień za pomocą oświetlenia wymazu wcześniej zwilżonym kilkoma kroplami kwaśnego alkoholu, metanolu lub 70 % etanolu. Unikaj używania dużego wymazu namoczonego w etanolu, ponieważ jest to ryzyko pożaru.
Umyj plamę
To mycie należy wykonać za pomocą czystej wody. Jeśli woda z kranu nie jest czysta, umyj tarcie za pomocą filtrowanej lub destylowanej wody, najlepiej.
Przykryj rozmaz alkohol kwasowym
Ten alkohol kwasowy musi wynosić 3 %. Zakres jest przeprowadzany przez 5 minut lub do momentu, aż zapach zostanie wystarczająco odbarwiony, to znaczy jasnoróżowe.
Może ci służyć: epiblastNależy wziąć pod uwagę, że alkohol kwaśny jest łatwopalny; Dlatego należy go używać bardzo ostrożnie. Unikaj bycia blisko źródeł zapłonu.
Umyj plamę
Mycie powinno być z czystą, destylowaną wodą.
Przykryj rozmaz barwnikiem
Może to być kolorowanie zielone (0,5 %) lub błękit metylenowy (0,3 %) przez 1 lub 2 minuty, przy użyciu głośniejszego czasu, jeśli zapach jest cienki.
Umyj plamę
Czysta woda (destylowana) powinna być ponownie użyta.
Osuszać
Tył slajdu należy wyczyścić, a plama jest umieszczona na półce drenażowej, tak aby wyschła w powietrzu (nie używa papieru chłonnego do suszenia).
Zbadaj rozmaz w mikroskopie
Należy zastosować cel 100x i oleju zanurzenia. Systematycznie zeskanuj rozmaz i zapisz odpowiednie obserwacje.
Interpretuj wyniki
Teoretycznie mikroorganizmy, które są barwione z czerwonawego koloru, są uważane za dodatni kwas alkoholowy (AAR+).
Przeciwnie, jeśli mikroorganizmy są barwione na niebiesko lub zielone, w zależności od barwnika stosowanego jako kontratak, są one uważane za ujemny kwas oporny (AAR-).
Bibliografia
- Apurba, s. & Sandhya, b. (2016). Niezbędne rzeczy praktycznej mikrobiologii (1. wyd.). Jaypee Brothers Medical Publishers.
- Bauman, r. (2014). Mikrobiologia z Deseodas według systemu ciała (czwarta edycja.). Pearson Education, Inc.
- Heritage, J., Evans, e. & Killington, a. (1996). Mikrobiologia wprowadzająca (1. wyd.). Cambridge University Press.
- Morello, J., Granato, str. Wilson, m. I Morton, V. (2006). Podręcznik laboratoryjny i skoroszyt w mikrobiologii: Zastosowania do opieki nad pacjentem (11 wyd.). McGraw-Hill Education.
- Vasanthakumari, r. (2007). Podręcznik mikrobiologii (1. wyd.). B.Siema. Publikacje Pvt.

