Eter etylowy

- 4513
- 416
- Paweł Malinowski
 Eter etylowy jest niestabilną i łatwopalną cieczą, która służyła jako znieczulenie w dziewiętnastym wieku
Eter etylowy jest niestabilną i łatwopalną cieczą, która służyła jako znieczulenie w dziewiętnastym wieku Co to jest eter etylowy?
On Eter etylowy, Znany również jako eter dietetylowy, jest to związek organiczny, którego wzór chemiczny wynosi C4H10ALBO. Charakteryzuje się byciem bezbarwnym i niestabilnym płynem, a zatem jego butelki muszą być zamknięte tak szczelnie, jak to możliwe.
Ten eter. To znaczy mają formułę ROR, w której r i r 'reprezentują różne segmenty gazowane. I jak opisano jego drugą nazwę, eter dietelowy, są dwoma rodnikami -etylowymi, które są powiązane z atomem tlenu.
Początkowo eter etylowy zastosowano jako znieczulenie ogólne, wprowadzone w 1846 r. Przez Williama Thomasa Green Mortona. Jednak ze względu na jego łatwopalność jego użycie zostało odrzucone, zastępując go innymi mniej niebezpiecznymi środkami znieczulającymi.
Ten związek został również wykorzystany do obliczenia czasu krążenia krwi, podczas oceny stanu sercowo -naczyniowego pacjenta.
Struktura eteru etylowego
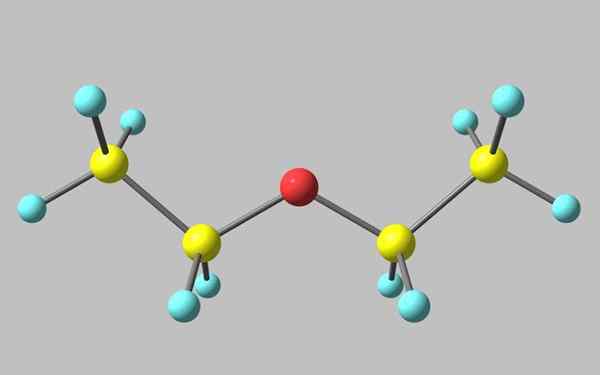 Struktura chemiczna eteru etylowego
Struktura chemiczna eteru etylowego Na lepszym obrazie istnieje reprezentacja z modelem kul i słupków struktury molekularnej eteru etylowego.
Jak widać, czerwona kula, odpowiadająca atomowi tlenu, ma dwie grupy etylowe połączone z obiema stronami. Wszystkie łącza są proste, elastyczne i swobodny obrót wokół osi σ.
Rotacje te pochodzą ze stereoizomerów znanych jako konformery, które bardziej niż izomery są alternatywnymi staniami przestrzennymi. Struktura obrazu odpowiada dokładnie antykonformatorowi, w którym wszystkie jego grupy atomowe są rozłożone (oddzielone od siebie).
Drugi konfruero jest przyćmiony i chociaż nie jest to dostępny obraz, wystarczy go wizualizować za pomocą w kształcie litery U. Na górnych końcach U grupy metylowe byłyby zlokalizowane, -ch3, który doświadczyłby odpychania Sterycznego (zderzałyby się w przestrzeni).
Może ci służyć: Faraday ConstantDlatego można oczekiwać, że cząsteczka Cho3Ch2Och2Ch3 Przyjmuje się przez większość czasu.
Właściwości fizyczne i chemiczne Eter etylowy
Inne nazwy
- Eter dietylowy
- Etoxytano
- Tlenek etylu
Formuła molekularna
C4H10O O (C2H5)2ALBO.
Waga molekularna
74.14 g/mol.
Wygląd fizyczny
Bezbarwny płyn.
Zapach
Słodki i pikantny.
Smak
Płoną i słodko.
Punkt wrzenia
94.3 ° F (34.6 ° C) przy 760 mm Hg.
Temperatura topnienia
-177.3 ° F (-116.3 ° C). Stabilne kryształy.
punkt zapłonu
-49 ° F (zamknięty pojemnik).
Rozpuszczalność wody
6.04 g/100 ml w 25 ° C.
Rozpuszczalność w innych płynach
Mamiczne z krótkim łańcuchem alifatycznym, benzenu, chloroformu, eterem olejowym, rozpuszczalnikiem tłuszczowym, wieloma olejami i skoncentrowanym kwasem chlorowodorowym.
Rozpuszczalne w acetonie i bardzo rozpuszczalne w etanolu. Jest również rozpuszczalny w benzynie, benzenie i olejach.
Gęstość
0.714 mg/ml w 68 ° F (20 ° C).
Gęstość pary
2.55 (w odniesieniu do powietrza pobranego z gęstością 1).
Ciśnienie pary
442 mm Hg w 68 ° F. 538 mm Hg w 25 ° C. 58,6 kPa w 20 ° C.
Stabilność
Powoli utlenia się przez działanie powietrza, wilgotności i światła z tworzeniem się nadtlenkami.
Powstawanie nadtlenków może wystąpić w eterowych pojemnikach, które były otwarte i pozostają w przechowywaniu przez ponad sześć miesięcy. Nadtlenki mogą wywołać tarcie, uderzenie lub ogrzewanie.
Należy unikać kontaktu z: cynkiem, halogenami, nie -metalowymi oksyturami, silnymi środkami utlenianiem, chlorkiem chromu.
Immon
356 ° F (180 ° C).
Rozkład
Kiedy się rozgrzewa, załamuje się, emitując akr i irytujący dym.
Breja
0.2448 POISE w 20 ° C.
Ciepło spalania
8.807 kcal/g.
Może ci służyć: einstenio (y): struktura, właściwości, uzyskiwanie, użyciaCiepło parowe
89.8 limonki/g A 30 ° C.
Napięcie powierzchniowe
17.06 Dynas/cm w 20 ° C.
Potencjał jonizacji
9.53 eV.
Zapach próg
0.83 ppm (czystość nie jest podana).
Współczynnik załamania światła
1.355 do 15 ° C.
Uzyskanie Eter etylowy
Eter etylowy z alkoholu etylowego można uzyskać, w obecności kwasu siarkowego jako katalizatora. Kwas siarkowy w wodnej pożywce dysocjuje wytwarzanie jonu hydronowego, h, h3ALBO+.
W przeciwnym procesie, to znaczy nawodnienie etylenu w fazie pary, eter etylowy może tworzyć się jako produkt zabezpieczony oprócz alkoholu etylowego. W rzeczywistości ta syntetyczna trasa wytwarza większość tego związku organicznego.
Toksyczność Eter etylowy
Może powodować podrażnienia skóry i oczu. Kontakt skóry może wywołać resekcję i pękanie. Eter zwykle nie wnika do skóry, ponieważ jest szybko odparowany.
Podrażnienie oczu spowodowane przez eter jest zwykle łagodny, aw przypadku poważnego podrażnienia uszkodzenie jest ogólnie odwracalne.
Jego spożycie powoduje działanie narkotyczne i podrażnienie żołądka. Ciężkie spożycie może spowodować uszkodzenie nerek.
Wdychanie eterowe może powodować podrażnienie nosa i gardła. W przypadku inhalacji eteru można go wytwarzać: senność, podniecenie, zawroty głowy, wymioty, nieregularne oddychanie i wzrośnie.
Wysoka ekspozycja może powodować utratę wiedzy, a nawet śmierć.
OSHA ustanawia średnio 800 ppm, podczas 8 -godzinnej zmiany.
Poziomy podrażnienia oka: 100 ppm (ludzie). Poziomy podrażnienia oka: 1200 mg/m3 (400 ppm).
Używa/aplikacje Eter etylowy
Rozpuszczalnik organiczny
Jest to organiczny rozpuszczalnik używany do rozpuszczenia bromu, jodu i innych halogenów. Większość lipidów (tłuszczów), żywic, czystych gumów, niektórych alkaloidów, gumaków, perfum, octanu celulozy, azotanu celulozy, węglowodorów i barwników.
Może ci służyć: bez metali: historia, właściwości, grupy, użyciaPonadto jest stosowany w ekstrakcji aktywnych składników tkanek zwierzęcych i roślin, ponieważ ma mniej gęstości niż woda i unosi się na niej, pozostawiając pożądane substancje rozpuszczone w eterze.
Ogólne znieczulenie
Był stosowany jako znieczulenie ogólne od 1840 roku, zastępując chloroform, aby mieć przewagę terapeutyczną. Jest to jednak łatwopalna substancja, a zatem występuje poważne trudności w jej stosowaniu na obszarach klinicznych.
Ponadto produkuje u pacjentów pewne niepożądane pooperacyjne skutki uboczne, takie jak nudności i wymioty.
Z tych powodów użycie eteru zostało odrzucone jako ogólne znieczulenie, zastępując go innymi znieczuleniem, takimi jak Halotano.
Duch eterowy
Eter mieszany etanol.
Ocena krążenia krwi
Eter został wykorzystany do oceny krążenia krwi między jednym ramieniem a płucami. Eter jest wstrzyknięty do ramienia, zabierając krew do prawego przedsionka, a następnie do prawej komory, a stamtąd do płuc.
Czas, który upływa od wstrzyknięcia eteru, do przechwytywania zapachu eteru w wydychanym powietrzu, wynosi około 4 do 6 s.
Nauczanie laboratoriów
Eter jest wykorzystywany w nauczaniu laboratoriów w wielu eksperymentach. Na przykład w demonstracji praw genetycznych Mendla.
Eter służy do odrętwienia much płciowych Drosophila i pozwól niezbędnym krzyżom między nimi, aby podkreślić prawa genetyki.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. Chemia organiczna. Aminy. Wiley Plus.
- Ether Ether. Odzyskane z Britannica.com

