Molekularna teoria orbitalna

- 3170
- 913
- Gabriela Łuczak
Co to jest molekularna teoria orbitalna?
Molekularna teoria orbitalna (Tom) Jest to model matematyczny opracowany w celu wyjaśnienia właściwości fizykochemicznych cząsteczek, takich jak wchłanianie i emisja promieniowania, przewodność elektryczna, a także elektroniczny charakter jego powiązań. Uwzględnia to, w przeciwieństwie do teorii linków Valencia (TEV), że elektrony są przenoszone w całej cząsteczce, bez probabilistycznego zlokalizowania w linkach.
Dlatego molekularna teoria orbitalna stosuje te same zasady kwantowe, które dyktują funkcje falowe dla orbitali atomowych, opisując w ten sposób stan energetyczny elektronów w atomach; Dopiero teraz odnosi się do okołów molekularnych SO, pochodzących z liniowych kombinacji orbitali atomowych atomów, które są.
 Paramagnetyzm ciekłego tlenu, a zatem jego przyciąganie magnesów, jest wyjaśnione dzięki teorii orbitalnej molekularnej. Źródło: Pieter Kuipeper przez Wikipedia.
Paramagnetyzm ciekłego tlenu, a zatem jego przyciąganie magnesów, jest wyjaśnione dzięki teorii orbitalnej molekularnej. Źródło: Pieter Kuipeper przez Wikipedia. Działa zatem teoria molekularna, pracując z orbitalami molekularnymi, ich rozkładami elektronicznymi i przestrzennymi, a także schematami ich energii, które umożliwiają obserwowanie luk energii, które je oddzielają. Przede wszystkim wyjaśnia paramagnetyzm niektórych substancji, takich jak tlen molekularny w stanie ciekłym (patrz wyżej).
O2, Opisany przez struktury Lewisa i teorię łącza Walencji, ma wszystkie sparowane elektrony, więc teoretycznie powinien być diamagnetyczny. Jednak w praktyce wykazano, że w rzeczywistości jest paramagnetyczny, to znaczy brakuje elektronów; w szczególności para brakujących elektronów.
Z budowy diagramu OM (orbitale molekularne) dla O2, Homonuklearna cząsteczka okrzemkowa, można zauważyć, że w efekcie pojawią się dwa brakujące elektrony o wysokiej energii. Nie tylko to, ale spin i położenie tych elektronów w OMS wyjaśniają również inne stany elektroniczne OR2 (pojedynczy).
Inne z najważniejszych triumfów teorii orbity molekularnej jest to, że pomaga przewidzieć możliwe istnienie cząsteczek dwuatomicznych, a także ich względną stabilność. Zatem molekularna teoria orbitalna jest właściwa w przewidywaniu cząsteczek, takich jak B2 i Li2, Nawet gdy mogą wykrywać tylko w fazie pary w wysokich temperaturach. Ponadto teoria ta odrzuca istnienie hipotetycznego, które mam2 lub NE2.
Rodzaje wiązań molekularnych i orbitali
Podobnie jak w przypadku teorii łącza walencji, w teorii orbity molekularnej rozważa się kilka rodzajów linków w zależności od kierunkowości nakładania się orbitali atomowych uczestniczących w wiązaniu chemicznym. Wśród najważniejszych i obecnych w naturze molekularnej mamy wiązania Sigma i Pi.
Sigma
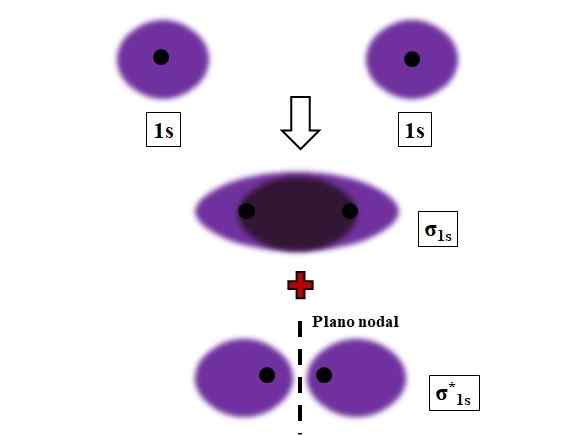 Tworzenie linków σ1 i σ1s* podczas nakładania się dwóch orbitali atomowych 1s. Źródło: Gabriel Bolívar.
Tworzenie linków σ1 i σ1s* podczas nakładania się dwóch orbitali atomowych 1s. Źródło: Gabriel Bolívar. Sigma, wiązania σ są ustalane, gdy orbitale atomowe pokrywają.
Rozważmy na przykład łącze σ, które powstaje, gdy dwa orbitale atomowe 1S, zgodnie z atomem wodoru, są zbliżone do bardzo krótkiej odległości (obraz powyżej). Ponieważ orbitale 1S są symetryczne, ich nakładanie się zawsze będzie frontowe; Dlatego zawsze generują orbitale molekularne σ1s i σ1s*.
Zwróć teraz uwagę na to, że orbital molekularny σ1s pokazuje gęstość elektroniczną skoncentrowaną w przestrzeni, która oddziela dwa jądra. Oznacza to, że na orbicie σ1s Prawdopodobieństwo znalezienia elektronu jest maksymalne w tym regionie cząsteczki. Elektrony σ1s Są przenoszone w przestrzeni, która obejmuje fioletowy kolor.
Z drugiej strony, na orbicie σ1s* Mamy płaszczyznę węzłową między dwoma jąderkami. Oznacza to, że prawdopodobieństwo znalezienia elektronu między tą przestrzenią jest równe zero. Zauważ, że na orbicie σ1s* Elektrony opisują pozycje wokół każdego z dwóch jąder; nie wokół cząsteczki jako całości.
Może ci służyć: radio: struktura, właściwości, użycia, uzyskiwanieLiczba Pi
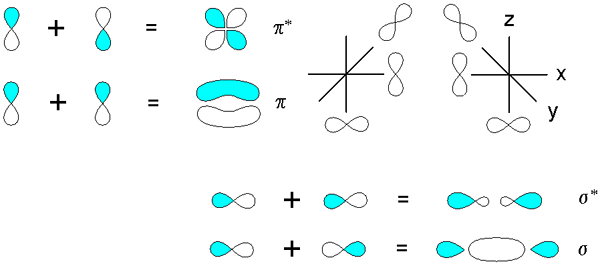 Wiązania Sigma i Pi pochodzące z nakładania się orbitali p. Źródło: v8rik at in.Wikipedia, CC BY-SA 3.0, Via Wikimedia Commons
Wiązania Sigma i Pi pochodzące z nakładania się orbitali p. Źródło: v8rik at in.Wikipedia, CC BY-SA 3.0, Via Wikimedia Commons Rozważ teraz wiązania molekularne i orbitale. Dzieją się one, gdy nakładanie się orbitali następuje w kierunku prostopadłym do osi międzyjądrowej, która jest arbitralnie przymocowana w dowolnej osie płaszczyzny kartezjańskiej. Zakładając, że mówimy o orbitalie 2pX, Orbital 2pI Będzie swobodnie ustanowienie linku PI (patrz niebieskie i białe płaty).
Gdy dwa orbitale 2pI Pochodzą dwa orbitale molekularne: π2py i π2py*; Pierwszy ma najwyższą gęstość elektroniczną i poniżej oś międzyjądrowej, podczas gdy drugi przypomina czterpetalowy kwiat, w którym prawdopodobieństwo znalezienia elektronów jest znacznie niższe.
Z drugiej strony orbitale 2p, aby powiedzieć 2pX, Mogą również nakładać się na przód, aby powstać wiązanie σ i dwa orbitale molekularne σ2px i σ2px*. Jak w przypadkach σ1s i σ1s*, Orbital σ2px pokazuje większą gęstość elektroniczną między dwoma jąderami; co jest sprzeczne z σ2px*, gdzie elektrony są zorientowane na boki na zewnątrz.
Połączyć
Lindingowe orbitale molekularne to te, które przyczyniają się do stabilności cząsteczki. Oznacza to, że muszą mieć mniej energii w porównaniu z orbitali atomowych poszczególnych atomów przed powiązaniem i utworzeniem cząsteczki. W tych orbitalach elektrony są przenoszone przez wszystkie wymiary cząsteczki jako całości.
Na schematach OM zawsze znajdują się one poniżej orbitali atomowych, które połączyły się, aby. Będzie to widoczne bardziej szczegółowo w następnych sekcjach.
Anty -hut
Z drugiej strony przeciwbaszynowe orbitale molekularne to te, które destabilizują cząsteczkę. Są symbolizowane gwiazdką (*), a ich energie są wyższe niż w przypadku orbitali atomowych, które je powstały. W tych orbitalach elektrony są przenoszone dość nieregularnie, tak jakby cząsteczka była fragmentowana elektronicznie.
Na schematach OM zawsze będą znajdować się nad orbitali atomowych, które połączyły się, aby.
Nie połączone
Tymczasem orbitale niekinujące, a także ich elektrony, to te, które nie wnoszą ani nie szkodzą stabilności cząsteczki. Jego energie są bardzo podobne do energii orbitali atomowych.
Zamówienie linku
Kolejność łącza staje się w teorii orbity molekularnej, podobnie jak numer łącza w teorii łącza Valencia: miara siły łącza w cząsteczce. Zatem kolejność łącza równa 1 odpowiada prostemu linkowi (-). I zamówienie linku (lub.e) równe 2, odpowiada podwójnemu wiązaniu (=). Wkrótce.
Kolejność jest określana na podstawie zliczania elektronów na schematach OM dla określonej cząsteczki. Aby to zrobić, należy zastosować następującą formułę:
albo.E = (liczba połączonych elektronów - liczba elektronów anty -hutowych)/2
Elektrony łącza przyczyniają się do cząsteczki do stabilizacji, podczas gdy elektrony antyfifiżujące ją destabilizują. Dlatego im bardziej elektrony przeciwbędowe, mniejsze lub.E, a cząsteczka będzie zwykle bardzo niestabilna. Kiedy O.E jest równe 0, oznacza to, że cząsteczka nie istnieje (lub przynajmniej teoretycznie).
OM Diagramy
Na schematach OM reprezentowane są energie orbitali molekularnych, a jego elektroniczne wypełnienie jest również wizualizowane, co jest przestrzegane zasadami AUFbauf i Sinn, a także zasady wykluczenia Pauling. Rozważmy na przykład następujące dwa schematy:
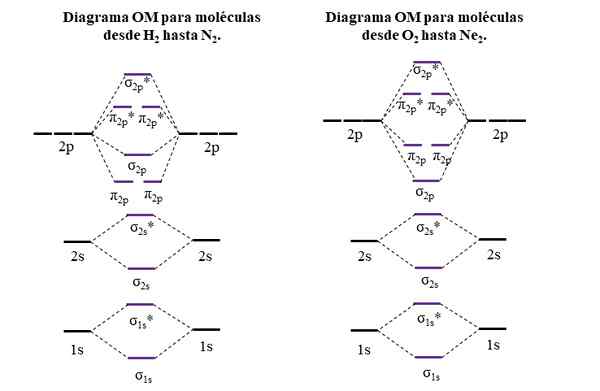 Diagramy OM dla cząsteczek pierwszego i drugiego okresu stolika okresowego. Źródło: Gabriel Bolívar.
Diagramy OM dla cząsteczek pierwszego i drugiego okresu stolika okresowego. Źródło: Gabriel Bolívar. Poziome linie po bokach, czarne, reprezentują energie orbitali atomowych. Zamiast tego centralne poziome linie, fioletowe, są energią orbitali molekularnych. Zwróć uwagę, w jaki sposób łączące i antyagentowe OM są rozmieszczone (*) w odniesieniu do orbitali atomowych poszczególnych atomów.
Może ci służyć: grupa aminowa (NH2): struktura, właściwości, przykładyZwróć również uwagę, że na prawym schemacie OM σ2 p Zmieniają miejsce z π2 p. Dzieje się tak w przypadku cząsteczek O2, F2, i hipotetyczne NE2.
Przykłady
W poniższych przykładach OM będzie kontynuować elektrony, obliczy kolejność łącza i dokonuje prognoz siły wiązania lub stabilności danej cząsteczki.
H2
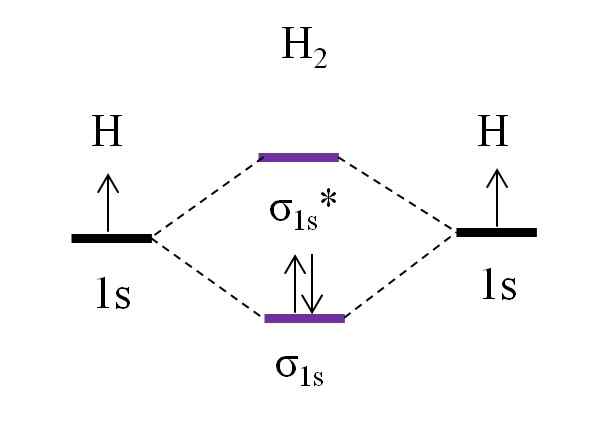 Diagram OM dla cząsteczki dihydrogenu. Źródło: Gabriel Bolívar.
Diagram OM dla cząsteczki dihydrogenu. Źródło: Gabriel Bolívar. Zaczynając od najprostszej cząsteczki, dihydrogenu, H2, Dwa atomy H są połączone przez połączenie dwóch orbitali atomowych 1S z tworzeniem dwóch orbitali molekularnych σ1s i σ1s*. Następnie dwa elektrony wypełniają orbitale molekularne.
Najpierw Orbital σ jest wypełniony1s, Ponieważ jest to najmniejsza energia (zasada Aufbaufa). Następnie drugi elektron musi zakończyć wypełnianie orbity σ1s Przed wspinaniem się na orbital σ1s* (Zasada zlewu). I wreszcie, ten drugi elektron prowadzi swój spin w przeciwnym kierunku do pierwszego elektronu (zasada wykluczenia Paulinga). Zatem dwa elektrony znajdują się w połączonym orbicie σ1s.
A co z kolejnością linku? W linku molekularna orbital σ1s Mamy 2 elektrony; Podczas gdy w orbicie molekularnej przeciw homosurze σ1s* Nie mamy żadnych. Dlatego obliczenia wyniosłyby:
albo.E = (2-0)/2
= 1
Być lub.I równe 1 oznacza to, że łącze jednoczące dwa atomy wodoru jest proste: H-H. Zasadniczo, jeśli wartość ta jest równa lub większa niż 1, mówi się, że cząsteczka istnieje i jest stabilna.
On2
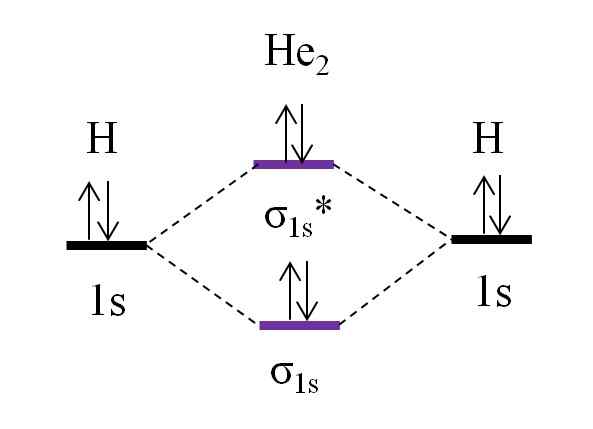 Diagram OM dla hipotetycznej cząsteczki dihelio. Źródło: Gabriel Bolívar.
Diagram OM dla hipotetycznej cząsteczki dihelio. Źródło: Gabriel Bolívar. Teraz przypuśćcie, że masz cząsteczkę2. Powyżej widzimy, że jego diagram OM jest bardzo podobny do H2, Z 2 dodatkowymi elektronami znajdującymi się na orbicie σ1s*. Gdy jest w sumie 4 elektrony dodające dwa atomy, wówczas we wszystkich powstałych orbitalach molekularnych muszą być również 4 elektrony.
Określenie o.E za ja2 będziemy mieli:
albo.E = (2-2)/2
= 0
Oznacza to, że nie ma możliwego ogniwa, że dwa atomy helu. W rzeczywistości do tej pory nie zidentyfikowano istnienia tej cząsteczki, co zgadza się z prognozami teorii orbitalnej molekularnej.
B2
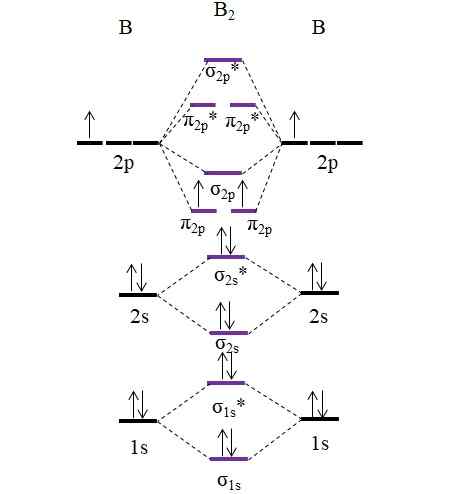 Diagram OM dla cząsteczki B2. Źródło: Gabriel Bolívar.
Diagram OM dla cząsteczki B2. Źródło: Gabriel Bolívar. Należy zauważyć, że w tworzeniu orbitali molekularnych wzięte są również elektrony warstw wewnętrznych; Nie tylko te z Walencji.
Zatem w przykładzie cząsteczki diboro, b2, Każdy atom boru przyczynia się łącznie 5 elektronów, z których 3 pochodzi z Walencji; Są to, te z ich orbitali 2s i 2p. Dwa elektrony orbitali 2p są umieszczone w różnych orbitalach molekularnych π2 p Z równoległymi kolcami (zasada zlewu).
Następnie obliczamy zamówienie linku:
albo.E = (6-4)/2
= 1
Dlatego oczekuje się, że cząsteczka będzie miała prosty link B-B. B2 Jest to cząsteczka, która istnieje tylko w etapie pary w bardzo wysokich temperaturach, ponieważ bor w normalnych warunkach przyjmuje bardziej złożone struktury i projekty sieciowe.
C2 i C22-
Rozważ najpierw schemat OM dla cząsteczki C2:
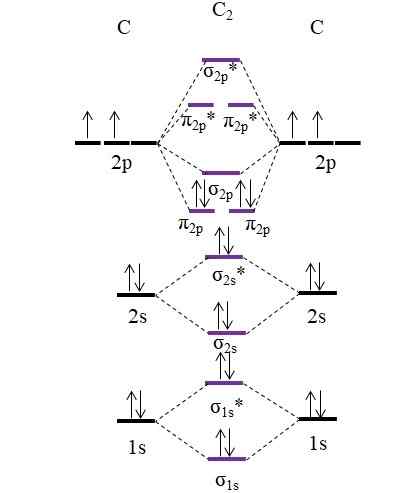 Diagram OM dla cząsteczki C2. Źródło: Gabriel Bolívar.
Diagram OM dla cząsteczki C2. Źródło: Gabriel Bolívar. Teraz dwa nowe elektrony dostarczone przez atomy węgla są ponownie umieszczone w orbitalach molekularnych π2 p Ale z przeciwnymi spinami (zasada wykluczenia Paulinga).
Określenie zamówienia linku, które będziemy mieli:
albo.E = (8-4)/2
= 2
Zauważ, że orbitale molekularne π2 p Dodaj 4 elektrony wiązania z wzorem. Będąc tym zamówieniem równym 2, oznacza to, że cząsteczka C2 Ma podwójne wiązanie, c = c. Ponownie, cząsteczka C2, Nazywany również węglem dwuatomicznym, istnieje tylko faza pary w wysokich temperaturach i jest to jedna z najprostszych alotropowych form węgla.
A co z C22-? Twój schemat OM jest następujący:
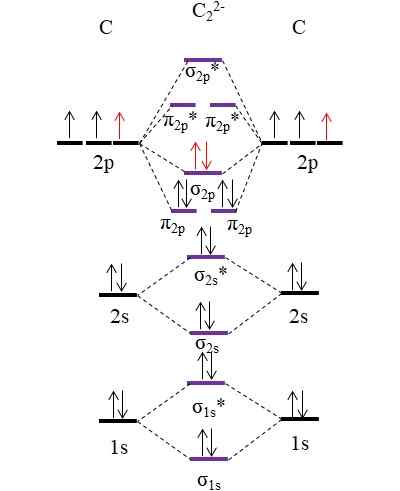 Diagram OM dla anionu C22-. Źródło: Gabriel Bolívar.
Diagram OM dla anionu C22-. Źródło: Gabriel Bolívar. Dwa nowe elektrony (czerwone strzałki) są umieszczone w linku molekularnym σ σ2 p. Zakłada się zatem, że każdy atom węgla wnosi jeden z dwóch ładunków ujemnych (dla stanu utleniania -1).
Może ci służyć: fulminacja rtęci: struktura, właściwości, uzyskiwanie, użyciaObliczanie zamówienia linku będziemy mieli:
albo.E = (10-4)/2
= 3
To znaczy anion c22-, Nazywany także anion acetylouro, ma potrójne ogniwo, [C≡C]2-. Jest to stosunkowo stabilny anion o wielkiej sile łącza; Jednak w zależności od jego odpowiednich jonów może powstać związki wybuchowe.
N2 oraz n2+
Słynna cząsteczka azotu, n2, Można go również doskonale opisać za pomocą molekularnych schematów orbitalnych:
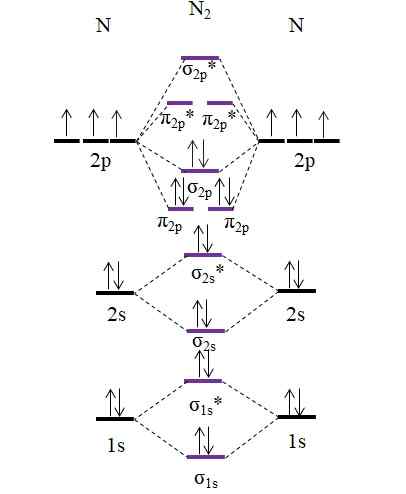 Diagram OM dla cząsteczki N2. Źródło: Gabriel Bolívar.
Diagram OM dla cząsteczki N2. Źródło: Gabriel Bolívar. Zauważ, że ten schemat jest dokładnie taki sam jak w przypadku anionu C22-. To oznacza, że n2 i C22- Są izolektroniczne. Jednak taki fakt nie oznacza, że oba gatunki zachowują się w ten sam sposób. Następnie2, neutralny, jest znacznie bardziej stabilny niż c22-, ujemne, nawet jeśli oba mają kolejność łącza równą 3, N≡N.
A co z kationem n2+? Spójrzmy na Twój schemat OM:
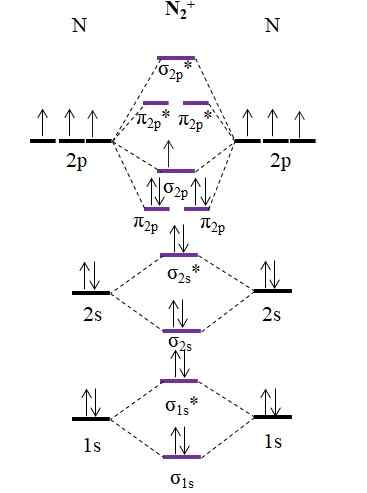 Diagram OM dla kationu n2+. Źródło: Gabriel Bolívar.
Diagram OM dla kationu n2+. Źródło: Gabriel Bolívar. Jak kation n2+ Ma o jeden mniej elektronów, jest to usuwane Orbital molekularny σ2 p. Następnie2 Jest diamagnetyczny, a n2+ Jest paramagnetyczny. A jego kolejność linków jest:
albo.E = (9-4)/2
= 2.5
Link 2 2.5 byłoby reprezentowane z dwiema liniami i jednym punktem. Jednak coś takiego nie ma sensu w teorii Walencji lub w strukturach Lewisa. Ponieważ ten kolejność linku jest mniejsza niż 3, siła linku obecnego w n2+ jest niższy niż n2, Więc jest bardziej niestabilny.
ALBO2, ALBO22- I22+
Zobaczmy teraz kolejną bardzo ważną cząsteczkę na całe życie: tlen molekularny lub diatomowy, lub2. Zgodnie z teorią Walencji i struktur Lewisa powinna być diamagnetyczna; Ale eksperymentalnie wykazano, że jest paramagnetyczny, więc zniknął gdzieś elektrony.
Poniżej porównujemy diagramy OM dla O2 i jony lub22- (tlenek) i o22+ (Utlenianie):
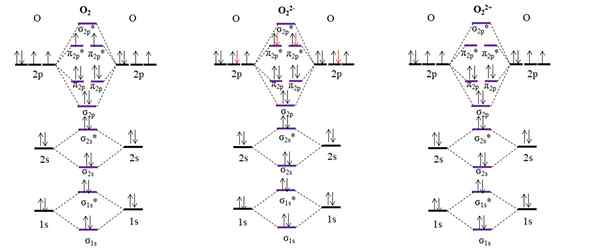 Diagramy OM dla tlenu cząsteczkowego i dwa z jego głównych jonów. Źródło: Gabriel Bolívar.
Diagramy OM dla tlenu cząsteczkowego i dwa z jego głównych jonów. Źródło: Gabriel Bolívar. Schemat OM dla O2 Próbka, w przeciwieństwie do poprzednich, że orbitale molekularne σ2 p i π2 p Zmień ich pozycję energetyczną. Również skutecznie widzimy, że w orbitach π istnieją dwa brakujące elektrony2 p*, który wyjaśnia paramagnetyczny charakter tlenu (wspomniany na początku artykułu).
Z drugiej strony mamy również diagram OM anion lub22-, nieskończenie rozprzestrzenianie się w kosmosie (księżyce, planety, komety, asteroidy itp.). Ma dwa dodatkowe elektrony (czerwone strzałki), które kończą napełnianie orbitali π2 p*, Pokonanie wszystkich elektronów. W konsekwencji OR22- Jest diamagnetyczny.
Rozważamy również schemat OM do utleniania lub22+. Ma dwa elektrony mniej niż O2, pozostawiając puste orbitale π2 p*. Wszystkie jego elektrony są sparowane, a zatem są diamagnetyczne.
Zamówienia łącza dla O2, ALBO22- I22+ Są odpowiednio: 2 (o = o), 1 [o-o]2- i 3 [O≡O]2+. Dlatego O22+ miałby najsilniejszy link.
Zalety i wady
Zalety
Wśród zalet teorii orbitalnej molekularnej możemy przytoczyć następujące czynności:
-Pozwala ocenić zlecenia łącza, że zwykły nie miałby większego sensu w teorii linków Valencia
-Dobrze koreluje z diamagnetyzmem i paramagnetyzmem cząsteczek
-Odległość, która oddziela orbitale cząsteczkowe na schematach, jest równa ΔE i służy do wyjaśnienia elektronicznego przejścia iloczyn wchłaniania fotonu
-Dotyczy nie tylko homonuklearnych cząsteczek dwuatomicznych, ale także w przypadku cząsteczek heteronuklearnych, takich jak CO2 i benzen
-Rozszerza swój model na inne rodzaje związków, takie jak kompleksy nieorganiczne, więc obsługuje teorię dziedziny ligandów
-Rozważanie, że elektrony są przenoszone w całej cząsteczce, jest wygodne, aby wyjaśnić wiele właściwości fizykochemicznych
Niedogodności
Oraz wśród niektórych wad molekularnej teorii orbitalnej, które mamy, aby zakończyć:
-Jest bardzo abstrakcyjny i wymaga głębokiego matematycznego zrozumienia, aby to w pełni zrozumieć
-Schematy cząsteczek jako CO2, Co, h2Lub inni, mogą być zbyt nudne, aby opracować i wyjaśniać
-Nie mówi nic o określonych regionach lub linkach dużej cząsteczki
-Nie dostarcza też żadnych informacji dotyczących geometrii molekularnej (płaszczyzna trygonalna, płaszczyzna kwadratowa, czworościenia itp.).
-Nie jest tak graficzny jak teoria linków Walencji
Podsumowując, molekularna teoria orbitalna jest teorią, która uzupełnia teorię łącza walencji, aby mieć szerszą i pełną panoramę widma molekularnego.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Orbitalowa teoria molekularna. Źródło: w:.Wikipedia.org
- Stephen Lower. (7 września 2020). Orbitalowa teoria molekularna. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Steven a. Hardinger. (2017). Orbitalowa teoria molekularna. Źródło: chemed.Chem.Purdue.Edu
- Książki prasowe. (S.F.). Rozdział 8: Teoria molekularna orbitalna. Źródło: openTextBC.AC

