Teoria morska podstawowych podstaw i nieruchomości
- 4560
- 172
- Filip Augustyn
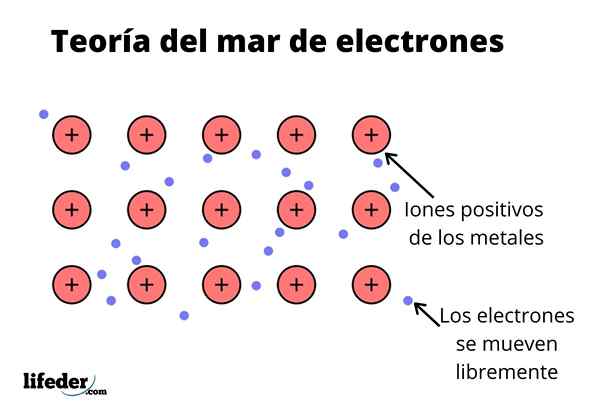
Teoria morza elektronowego Jest to hipoteza, która wyjaśnia wyjątkowe zjawisko chemiczne, które występuje w wiązaniach metali między pierwiastkami o niskiej elektroonywności. To jest dzielenie elektronów między różnymi zjednoczonymi atomami poprzez wiązania metalowe.
Gęstość elektroniczna między tymi wiązaniami jest taka, że elektrony są przenoszone i tworzą „morze”, w którym poruszają się swobodnie. Można go również wyrazić za pomocą mechaniki kwantowej: niektóre elektrony (zwykle są jeden do siedmiu na atom) są ułożone w orbitale z wieloma centrami rozciągniętymi przez powierzchnię metaliczną.
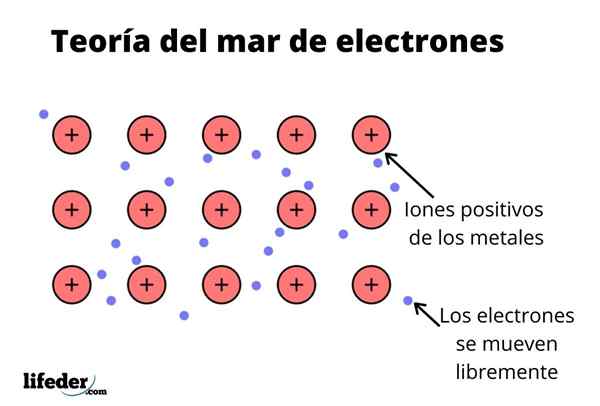
Ponadto elektrony zachowują pewne miejsce w metalu, chociaż rozkład prawdopodobieństwa chmury elektronicznej ma większą gęstość wokół niektórych specyficznych atomów. Dzieje się tak, ponieważ po zastosowaniu określonego prądu manifestują swoją przewodność w określonym kierunku.
[TOC]
Podstawy teorii morza elektronów
Elementy metalowe mają dużą tendencję do przekazywania elektronów najnowszego poziomu energii (warstwa walencyjna), ze względu na ich niską energię jonizacyjną w stosunku do innych pierwiastków.
Wiedząc o tym, każdy element metaliczny można uznać za kation powiązany z elektronem ostatniego poziomu energii, co byłoby bardziej podatne na darowiznę.
Podobnie jak w metalu istnieje duża liczba atomów, które są ze sobą połączone, można założyć, że metal ten tworzy grupę metalowych kationów, które są zanurzone w rodzaj morza elektronów walencyjnych, które mają dużą relokację.
Biorąc pod uwagę, że siły przyciągania elektrostatyczne między kationem (obciążenie dodatnie) a elektronem (obciążenie ujemne) mają silne połączenie atomów metalu, wyobraź sobie przeniesienie elektronów walencyjnych zachowujących się jako klej elektrostatyczny, który zachowuje się z kationami metalu.
Może ci służyć: polimeryW ten sposób można wywnioskować, że im większa liczba elektronów obecnych w warstwie walencji metalu, tego rodzaju elektrostatyczne klej będzie miała większą wytrzymałość.
Nieruchomości
Teoria morza elektronów oferuje proste wyjaśnienie charakterystyk gatunków metali, takich jak opór, przewodność, ciągliwość i plastyczność, które różnią się w zależności od metalu do drugiego.
Odkryto, że oporność przyznana metale jest spowodowana dużą relokacją ich elektronów, co generuje bardzo wysoką siłę spójności między atomami, które ją tworzą.
W ten sposób plastyczność jest znana jako zdolność niektórych materiałów do umożliwienia deformacji ich struktury, bez wystarczającej ilości zerwania, gdy są one poddane pewnym siłom.
Delokalizacja w postaci warstw
Zarówno plastyczność, jak i plastyczność metalu są określone przez fakt, że elektrony walencji są demokowane we wszystkich kierunkach w postaci warstw, co powoduje, że przemieszczają się przed działaniem siły zewnętrznej, unikając rozkładu struktury metalu, ale pozwalając na to jego deformacja.
Podobnie, swoboda ruchu elektronów przenoszonych umożliwia przepływ prądu elektrycznego, powodując bardzo dobrą przewodność energii elektrycznej.
Ponadto to zjawisko swobodnego ruchu elektronów umożliwia przenoszenie energii kinetycznej między różnymi obszarami metali, co promuje przekładnia ciepła i sprawia, że metale przejawiają wielką przewodność cieplną.
Może ci służyć: kwas jodozowy (Hio2): właściwości i zastosowaniaTeoria morza elektrony w kryształach metali
Kryształy to substancje stałe, które mają właściwości fizyczne i chemiczne - jako gęstość, punkt topnienia i twardości - które są ustalane przez rodzaje sił, które sprawiają, że cząsteczki, które je zawierają.
W pewnym sensie uważa się, że kryształy metali mają najprostsze konstrukcje, ponieważ każdy „punkt” sieci szklanej był zajęty przez atom samego metalu.
W tym samym sensie ustalono, że struktura kryształów metali jest na ogół sześcienna i koncentruje się na twarzach lub ciała.
Jednak gatunki te mogą również mieć sześciokątny kształt i mieć dość zwarte opakowanie, co daje im tę ogromną gęstość, która jest dla nich charakterystyczny.
Z tego powodu strukturalnego powiązania tworzone w kryształach metali różnią się od tych, które występują w innych klasach kryształów. W całej strukturze krystalicznej elektrony, które mogą tworzyć wiązania, jak wyjaśniono powyżej, są wcześniej wyjaśnione.

Wady teorii
W atomach metali istnieje niewielka ilość elektronów walencyjnych proporcjonalnych do ich poziomów energii; Oznacza to, że dostępna jest większa ilość stanów energii niż ilość połączonych elektronów.
Oznacza to, że ponieważ istnieje silna relokacja elektroniczna, a także pasma energii, które mają częściowo wypełnione, elektrony mogą poruszać się przez strukturę siatkową, gdy są poddawane pola elektrycznego z zagranicy, oprócz tworzenia oceanu elektronowego, które przyznaje przepuszczalność dla przepuszczalności dla sieć.
Może ci służyć: OxácidoTak więc związek metali jest interpretowany jako konglomerat jonów dodatnich połączonych morzem elektronów (obciążenie ujemne).
Istnieją jednak cechy, które nie są wyjaśnione przez ten model, takie jak tworzenie niektórych stopów między metaliami o określonych kompozycjach lub stabilność zbiorowych połączeń metali, między innymi.
Te niedogodności są wyjaśnione przez mechanikę kwantową, ponieważ zarówno ta teoria, jak i wiele innych podejść zostały ustalone w oparciu o najprostszy model pojedynczego elektronu, jednocześnie próbując zastosować w znacznie bardziej złożonych strukturach atomów wielopoziomowych.
Bibliografia
- Wikipedia. (2018). Wikipedia. Odzyskane z.Wikipedia.org
- Holman, J. S., I Stone, P. (2001). Chemia. Odzyskane z książek.Google.współ.Iść
- Parkin, g. (2010). Wiązanie metalu metalu. Odzyskane z książek.Google.współ.Iść
- Rohrer, g. S. (2001). Struktura i wiązanie w materiałach krystalicznych. Odzyskane z książek.Google.współ.Iść
- Ibach, h., i Lüth, H. (2009). Fizyka stanu stałego: wprowadzenie do zasad nauki materiałowej. Odzyskane z książek.Google.współ.Iść
- « Proces hybrydyzacji kulturowej, typy i przykłady
- 20 miejsc turystycznych Aguascalientes (zdjęcia) »

