Przykłady aromatyczne nukleofilowe substytucje, przykłady
- 3904
- 547
- Matylda Duda
Aromatyczne podstawienie nukleofilowe (SNAR) to reakcja występująca w chemii organicznej, która polega na przemieszaniu dobrej grupy wychodzącej przez nadchodzącego nukleofil. Z punktu widzenia jego mechanizmu i aspektów elektronicznych jest to przeciwna powierzchnia aromatycznego podstawienia elektrofilowego (SEAR).
Zasadniczo grupa wychodząca jest halogenem, który pojawia się jako haluro x anion-. Ta reakcja może nastąpić tylko wtedy, gdy pierścień aromatyczny (głównie benzen) jest niedobór w elektronach; to znaczy, jeśli masz grupy podstawników atraktorów elektronów.
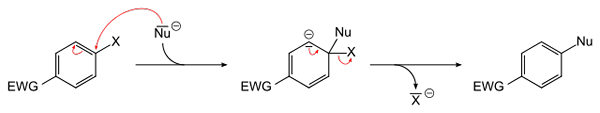
 Ogólne równanie aromatyczne substancję nukleofilową. Źródło: Sponk [domena publiczna]
Ogólne równanie aromatyczne substancję nukleofilową. Źródło: Sponk [domena publiczna] Najwyższy obraz schematów tego, co zostało powiedziane w poprzednim akapicie. EWG Electron Attractor Group (dla akronimu w języku angielskim: Grupa wycofywania elektronów), aktywuje pierścień aromatyczny dla ataku nukleofilowego ujemnego gatunku NU-. Można zauważyć, że powstaje pośrednik (w środku), z którego HaLuro X jest zwolniony lub zwolniony-.
Zauważ, że w prostych warunkach X jest zastępowany przez NU w aromatycznym pierścieniu. Ta reakcja jest bardzo wszechstronna i niezbędna w syntezie nowych leków, a także w badaniach syntetycznej chemii organicznej.
[TOC]
Główne cechy
Pierścień aromatyczny można „naładować” lub „pobieranie” z elektronów w zależności od ich podstawników (ci, którzy zastępują oryginalny link c-h).
Kiedy te podstawniki mogą przekazać gęstość elektroniczną na pierścień, mówi się, że wzbogacają go z elektronów; Jeśli wręcz przeciwnie, są to atraktory gęstości elektronicznej (wspomniane powyżej EWG), mówi się, że zubożały pierścień elektronów.
W każdym razie pierścień jest aktywowany dla specyficznej reakcji aromatycznej, podczas gdy jest dezaktywowany dla drugiego.
Na przykład mówi się, że aromatyczny pierścień bogaty w elektrony jest aktywny dla aromatycznego podstawienia elektrofilowego; Oznacza to, że możesz przekazać swoje elektrony na gatunki elektrofilanu i+. Jednak nie da elektronów na gatunek NU-, Ponieważ ujemne opłaty odparłyby się nawzajem.
Może ci służyć: molekularna teoria orbitalnaTeraz, jeśli pierścień jest biedny w elektronach, nie ma tego, jak dać je gatunkowi i+ (Sear nie występuje); Zamiast tego dostępność jest akceptowanie elektronów gatunku NU- (Rozwija się warczenie).
Różnice z aromatycznym podstawieniem elektrofilowym
Wyjaśniono ogólne aspekty wejścia, niektóre różnice między Snar a Sear można teraz wymienić:
- Pierścień aromatyczny działa jak elektrofil (słabe elektron) i jest atakowany przez nukleofil.
- Grupa wychodząca X jest zastąpiona z pierścienia; Nie h+
- Nie powstają żadne karbokacje, ale pośredniki o ładunku ujemnym, które można przenieść przez rezonans
- Obecność bardziej atrakcyjnych grup na pierścieniu przyspiesza substytucję zamiast spowolnić
- Wreszcie, grupy te nie ćwiczą dyrektorów, gdzie (w którym węgiel) wystąpi wymiana. Wymiana zawsze wystąpi w węglu powiązanym z wychodzącą grupą X.
Ostatni punkt jest również zilustrowany na obrazie: link C-X jest zepsuty, aby utworzyć nowy link C-Nu.
Efekty
Liczby podstawników
Oczywiście, tym biedniejsze w elektronach jest pierścieniem, tym szybcie. Rozważ następujący przykład przedstawiony na dolnym obrazie:
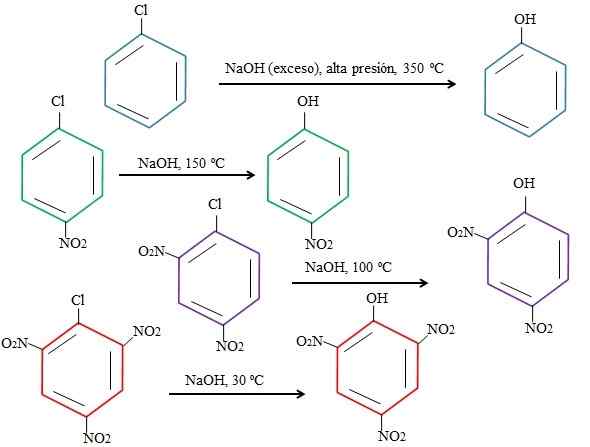 Wpływ podstawników na podstawienia 4-nitroclorobenzenu. Źródło: Gabriel Bolívar.
Wpływ podstawników na podstawienia 4-nitroclorobenzenu. Źródło: Gabriel Bolívar. Należy zauważyć, że 4-nitroclorobenzen (niebieski pierścień) wymaga drastycznych warunków (wysokie ciśnienie i temperatura 350 ° C) do wymiany CL za pomocą CL. W takim przypadku chlor jest grupą ustępującą (CL-) oraz wodorotlenek nukleofilowy (OH-).
Może ci służyć: 4 okresy chemii: od prehistorii do dziśKiedy grupa nie pojawia się2, który jest atraktorem elektronów (zielony pierścień), substytucję można przeprowadzić w temperaturze 150 ° C przy ciśnieniu otoczenia. Wraz ze wzrostem liczby grup nie2 obecne (fioletowe i czerwone pierścienie), wymiana ma miejsce w coraz bardziej niższych temperaturach (odpowiednio 100 ° C i 30ºC).
Dlatego grupy nie2 Przyspieszają warczenie i nie ulegają elektron do pierścienia, dzięki czemu jest bardziej podatny na atak OH-.
Względne pozycje CL nie zostaną tutaj wyjaśnione w odniesieniu do nie2 w 4-nitroclorobenzene i jak zmieniają prędkość reakcji; Na przykład prędkości reakcji 2-nitroclorobenzenu i 3-nitrochlorobenzenu są różne, przy czym te ostatnie są najwolniejsze w porównaniu z innymi izomerami.
Grupy ustępującej
Wracając do 4-nitroclorobenzenu, jego reakcja podstawienia jest wolniejsza, jeśli porównasz reakcję swojego fluorowanego odpowiednika:
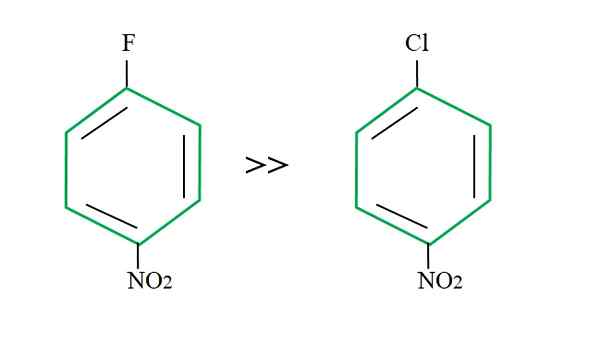 Wychodzący wpływ grupy na reakcje SNAR. Źródło: Gabriel Bolívar.
Wychodzący wpływ grupy na reakcje SNAR. Źródło: Gabriel Bolívar. Wyjaśnienie tego nie może leżeć w innej zmiennej, że różnica między F i Cl. Fluor jest kiepską grupą wychodzącą, ponieważ link c-f jest trudniejszy do złamania niż link c-cl. Dlatego rozkład tego łącza nie jest decydującym krokiem prędkości dla warczącego, ale dodaniem NU- do aromatycznego pierścienia.
Fluor dla bycia bardziej elektroungatywnym niż chlor, atom węgla powiązany z nim ma większy niedobór elektroniczny (Cδ+-Fδ-). W związku z tym węgiel C-F łącza jest znacznie bardziej prawdopodobne, że zostanie zaatakowany przez NU- niż link c-cl. Właśnie dlatego zastąpienie F przez OH jest znacznie szybsze niż Cl przez OH.
Może ci służyć: siarczek miedzi: struktura, właściwości, zastosowaniaPrzykład
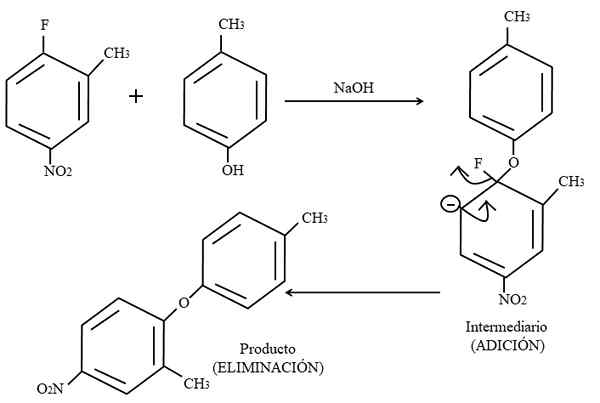 Aromatyczna wymiana elektrofilowa. Źródło: Gabriel Bolívar.
Aromatyczna wymiana elektrofilowa. Źródło: Gabriel Bolívar. Wreszcie przykład tego rodzaju reakcji organicznych na wyższym obrazie pokazano poniżej. Para-Coresol nie daje wyglądu nukleofilu; Ale posiadanie podstawowego pożywki, jego grupa OH jest niezabezpieczona, pozostawiając anion fenoksydowy, który atakuje 2-metylo-4-nitrofluorzenorzerze.
Kiedy nastąpi ten atak, mówi się, że nukleofil jest dodawany do elektrofilu. Ten etap można zobaczyć po prawej stronie obrazu, w którym powstaje związek pośredniego z obiema podstawnikami należącymi do pierścienia.
Dodając para-kurnikowy, pojawia się obciążenie ujemne, które przenosi rezonans wewnątrz pierścienia (zauważ, że przestaje być aromatyczny).
Na obrazie najnowsza struktura rezonansu jest ledwo pokazana, z której fluor jest wykończony jako F-; ale w rzeczywistości to ujemne obciążenie staje się dyskopiącze nawet w atomach tlenu grupy2. Po dodaniu eliminacji ostatnia, po czym jest ostatecznie uformowany produkt.
Ostateczny komentarz
Grupa nr2 pozostałe można zmniejszyć do grupy NH2, I stamtąd możliwe jest wykonanie większej liczby reakcji syntezy, aby zmodyfikować końcową cząsteczkę. Pokazuje to syntetyczny potencjał SNAR i że jego mechanizm, dodatkowo, składa się z dwóch etapów: jednego z dodatków i eliminacji.
Obecnie istnieją jednak dowody eksperymentalne i obliczeniowe, że w rzeczywistości reakcja przebiega po skoordynowanym mechanizmie, w którym oba kroki występują jednocześnie przez aktywowany kompleks, a nie pośrednik.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Wikipedia. (2019). Nukleofilowe podstawienie aromatyczne. Źródło: w:.Wikipedia.org
- James Ashenhurst. (6 września 2019). Podstawienie nukleofilowe aromatyczne (NAS). Odzyskane z: MastorganicChemistry.com
- Chemia librettexts. (5 czerwca 2019). Nukleofilowe podstawienie aromatyczne. Odzyskane z: chem.Librettexts.org
- « 50 zalecanych blogów gier wideo
- Historia okrężnictwa, właściwości, struktura, ryzyko, zastosowania »

