Siarczek cynkowy (ZNS)
- 4382
- 857
- Arkady Sawicki
 Siarczek cynkowy. Źródło: Wikimedia Commons
Siarczek cynkowy. Źródło: Wikimedia Commons Co to jest siarczek cynkowy?
On Siarczek cynkowy Jest to nieorganiczny związek wzoru ZNS, utworzone przez katacje Zn2+ i aniony2-. Występuje w naturze głównie jako dwa minerały: Wurtzit i Spheny (lub mieszanka cynku), przy czym ta ostatnia jest jej główną postacią.
Sfenhell jest przedstawiony w czarnej naturze ze względu na zanieczyszczenia, które przedstawia. Czysto przedstawia białe kryształy, a Wurtzita ma szarawe białe kryształy.
Siarczek cynkowy jest nierozpuszczalny w wodzie. Może powodować szkody środowiskowe, ponieważ wnika on do ziemi i zanieczyszcza wody gruntowe i ich prądy.
Siarczek cynku może wystąpić, między innymi reakcje, korozja i neutralizacja.
Przez korozję:
Zn +H2S => Zns +H2
Przez neutralizację:
H2S +Zn (OH)2 => Zns +2h2ALBO
Siarczek cynkowy to sól fosforescencyjna, która daje pojemność wielu zastosowań i zastosowań. Ponadto jest to półprzewodnik i fotokatyzacja.
Struktura siarczku cynku
Siarczek cynkowy przyjmuje struktury krystaliczne rządzone przez atrakcje elektrostatyczne między kationem Zn2+ i anion s2-. Są to dwa: Blenda Spheny lub cynku i Wurzita. W obu jonach minimalizuje odpychanie między równymi jonami.
Blenda cynku jest najbardziej stabilna w lądowych warunkach ciśnienia i temperatury; A Wurzita, która jest mniej gęsta, wynika z reorganizacji krystalicznej z powodu wzrostu temperatury.
Dwie struktury mogą jednocześnie współistnieć w tym samym Zns.
Blenda cynku
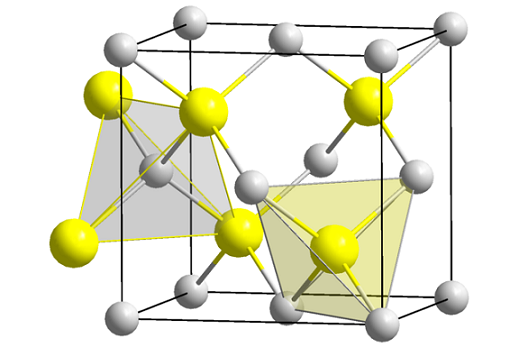
 Struktura mieszanki cynku (Spheny). Źródło: Wikimedia Commons
Struktura mieszanki cynku (Spheny). Źródło: Wikimedia Commons Najwyższy obraz pokazuje komórkę sześcienną wyśrodkowaną na twarzach struktury mieszanki cynku. Żółte kule odpowiadają anionom S2-, i szary do kationów Zn2+, położone w zakątkach i w centrach twarzy kostki.
Może ci służyć: Isobutil: Nomenklatura, szkolenie, struktura i cechyZwróć uwagę na geometrie czworościenne wokół jonów. Blenda cynku może być również reprezentowana przez te tetrahedry, których dziury wewnątrz szkła mają tę samą geometrię (tetraedralne zagłębienia).
Również proporcja ZNS jest spełniana w komórkach jednostkowych; to znaczy proporcja 1: 1. Zatem dla każdego kationu Zn2+ Jest anion2-. Na obrazie może się wydawać, że mnóstwo szarych kul, ale w rzeczywistości, gdy znajdują się w rogach i środku twarzy piasty, są one dzielone przez inne komórki.
Na przykład, jeśli cztery żółte kule, które znajdują się w pudełku, „kawałki” wszystkich szarych kulek powinny dodać to samo (i zrobić to), cztery. Zatem w sześciennej jednolitej komórce są cztery Zn2+ i cztery s2-, Proporcja stechiometryczna ZNS jest spełniona.
Podobnie ważne jest, aby podkreślić, że są otwory czworościenne do przodu i za żółtymi kulami (przestrzeń, która je oddziela od siebie).
Wurzita
 Struktura Wurzyt. Źródło: Wikimedia Commons
Struktura Wurzyt. Źródło: Wikimedia Commons W przeciwieństwie do struktury mieszanki cynku Wurzita przyjmuje sześciokątny system krystaliczny (obraz doskonały). Jest to mniej kompaktowe, więc ciało stałe ma mniejszą gęstość.
Jony w Wurzicie mają również środowiska czworościenne i proporcję 1: 1, która zgadza się z formułą Zns.
Właściwości siarczku cynku
Kolor
Można go przedstawić na trzy sposoby:
-Wurtzita, białych i sześciokątnych kryształów.
-Sfenhell, kryształów białych i kryształów sześciennych.
-Jako biały do szarawego lub żółtawego białego proszku i sześcienne żółtawe kryształy.
Temperatura topnienia
1.700 ° C.
Rozpuszczalność wody
Praktycznie nierozpuszczalne (0,00069 g/100 ml w 18 ° C).
Rozpuszczalność
Nierozpuszczalne u alkalis, rozpuszczalne w rozcieńczonych kwasach mineralnych.
Gęstość
Kule 4,04 g/cm3 i Wurtzita 4.09 g/cm3.
Twardość
Ma twardość od 3 do 4 w skali Mohs.
Stabilność
Podczas zawierania wody powoli utlenia siarczan. W suchym środowisku jest stabilny.
Rozkład
Po podgrzaniu w wysokich temperaturach emituje toksyczne opary cynku i siarków.
Może ci służyć: wodorek sodu (NaH): właściwości, reaktywność, zagrożenia, zastosowaniaNomenklatura siarku cynku
Konfiguracja elektroniczna Zn to [AR] 3D104s2. Podczas utraty dwóch elektronów Orbitalu 4S jest jak kation Zn2+ Z pełnym orbitalem. Dlatego, ponieważ elektronicznie Zn2+ Jest znacznie bardziej stabilny niż Zn+, Ma tylko wartościowość +2.
Stąd jest pominięte w nomenklaturze zapasowej, dodając jego wartościowość zamkniętą w nawiasach i z liczbami rzymskimi: siarczek cynkowy (ii).
Systematyczne i tradycyjne nomenklatury
Ale istnieją inne sposoby nazywania ZNS oprócz tego już podniesionego. W systematycznym liczba atomów każdego elementu jest określona w greckich licznikach, z jedynym wyjątkiem elementu po prawej stronie. Zatem Zns jest nazwany: kokSiarczek cynkowy (a nie monozinc monosulfuro).
Jeśli chodzi o tradycyjną nomenklaturę, do cynku, mając pojedynczą wartościowość +2, jest dodawana przez dodanie sufiks -co. W związku z tym jego tradycyjna nazwa to: Zínc Siarfidei co.
Zastosowanie siarczku cynku
Jako pigmenty lub powłoki
Sachtolith
Sachtolith to biały pigment wykonany z siarczku cynku. Jest stosowany w kinach, mastkach, szczeliwach, dolnych osłonach, farbach lateksowych i oznakowaniu.
Jego zastosowanie w połączeniu z chłonnymi pigmentami światła ultrafioletowego, takimi jak mikro tytan lub przezroczyste pigmenty tlenku żelaza, jest konieczne u pigmentów opornych na pogodę.
Zns i obrazy lateksowe
Gdy ZNS jest stosowany w obrazach lateksowych lub teksturowanych, ma przedłużone działanie mikrobobójców.
Ramy okien i samolotów
Ze względu na wielką twardość i odporność na pękanie, erozję, deszcz lub kurz, nadaje się do zewnętrznych okien podczerwieni lub w ramach samolotów.
Powłoka i inne zastosowania
Zns jest stosowany w powleczeniu wirników stosowanych w transporcie związków, aby zmniejszyć zużycie. Ponadto jest stosowany w produkcji atramentów drukowanych, związków izolacyjnych, pigmentacji termoplastycznej, tworzyw sztucznych odpornych na płomienie i lampy elektroluminescencyjne.
Może ci służyć: Tunsen Lost: Charakterystyka, funkcje, przykłady użytkowaniaUrządzenia i ekrany noktowizyjne
-Siarczek cynku może być przezroczysty, ponieważ można używać jako okna do widzialnej optyki i optyki na podczerwień. Jest używany w urządzeniach noktowizyjnych, na ekranach telewizyjnych, ekranach radarowych i powłokach fluorescencyjnych.
Elektroliminescencja
Doping Zns z Cu jest stosowany do produkcji paneli elektroluminescencyjnych. Ponadto jest stosowany w napędu i grawimetrii rakietowej.
Za fosforescencję
Jego fosforescencja służy do farbowania igieł zegara, a tym samym wizualizacji czasu w ciemności; Również w obrazach zabawek, sygnałów awaryjnych i zawiadomień o ruchu.
Fosforescencja pozwala na zastosowanie siarczku cynku w rurkach promieniowych katodowych i na ekranach X -Blay, aby zabłysnąć w ciemnych punktach. Kolor fosforescencji zależy od zastosowanego aktywatora.
Półprzewodnik, fotokatyzacja i katalizator
- Spheny i wurtzite są rozszczepem szerokopasmowego półprzewodników. Sphalerit ma rozszczep pasma 3,54 eV, podczas gdy Wurtzita ma bit opaski 3,91 eV.
- ZNS jest stosowany w przygotowaniu fotokatalizatora złożonego z CDS - Zns/cyrkonżu - fosforan tytanu, stosowany do produkcji wodoru w świetle widzialnym.
- Interweniuje jako katalizator degradacji zanieczyszczeń organicznych. Jest używany w przygotowaniu synchronizatora kolorów w lampach LED.
- Jego nanokryształy są używane do ultradensjonalnego wykrywania białka. Na przykład, wydając punkty kwantowe ZNS. Jest stosowany w przygotowaniu połączonego fotokatalizatora (CDS/ZNS) -TIO2 do produkcji elektrycznej poprzez fotoelektrocataliza.
Bibliografia
- Pubchem (2018). Siarczek cynkowy. Zaczerpnięte z: Pubchem.NCBI.NLM.Nih.Gov
- Quiminet (16 stycznia 2015). Biały pigment oparty na siarczku cynku. Odzyskany z: Quiminet.com
- Wikipedia (2018). Siarczek cynkowy. Zaczerpnięte z: w.Wikipedia.org
- II-VI UK (2015). Siarczek cynkowy (ZNS). Zaczerpnięte z: ii-vi.Jest
- Rob Toreki (30 marca 2015 r.). Struktura cynkblende (ZNS). Zaczerpnięte z: ILPI.com
- Chemistry Librettexts (22 stycznia 2017 r.). Struktura-Zinc Blende (ZNS). Zaczerpnięte z: chem.Librettexts.org
- Reade (2018). Siarczek siarczkowy/ cynk (ZNS). Zaczerpnięte z: czyt.com

