Struktura siarczanu miedzi (CUSO4), właściwości, uzyskiwanie, zastosowania
- 2077
- 236
- Matylda Duda
On siarczan miedzi Jest to związek nieorganiczny utworzony przez elementy miedzi (Cu), siarki i tlenu (O) (O). Jego formuła chemiczna to cuso4. Miedź znajduje się w stanie utleniania +2, siarka +6, a tlen ma walencję -2.
Jest białą substancją substancji stałej, że gdy jest narażona na wilgotność środowiska, staje się jego niebieskim pentahydratem4 •5h2ALBO. Białe ciało stałe uzyskuje się przez ogrzewanie niebieskiego w celu wyeliminowania wody.
 Siarczan miedzi (cuo4) bezwodne (bez wody w strukturze krystalicznej). W. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Siarczan miedzi (cuo4) bezwodne (bez wody w strukturze krystalicznej). W. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Od stuleci jest stosowany jako środek przeciwbakteryjny do leczenia ran u ludzi i zwierząt. Działa również jako grzybobójstwo, jako ściągający, antydiarrot i kontrolujące choroby jelitowe u zwierząt. Jest również stosowany jako środek antyhongos w roślinach.
Jednak niektóre z ich zastosowań zostały przerwane, ponieważ ich nadmiar może być toksyczny zarówno dla ludzi, zwierząt, jak i roślin. Odstęp stężeń, w którym można go zastosować, jest wąski i zależy od gatunku.
Jest stosowany jako katalizator w reakcjach chemicznych i jako rozpuszczalniki wysyłanie. Pozwala na poprawę odporności i elastyczności niektórych polimerów.
Nadmierne ilości tego związku mogą być szkodliwe dla gleb, ponieważ jest toksyczne dla mikroorganizmów, które są korzystne dla roślin.
[TOC]
Struktura
Siarczan miedzi jest tworzony przez jon miedzi (cu2+) i jon siarczanu (więc42-).
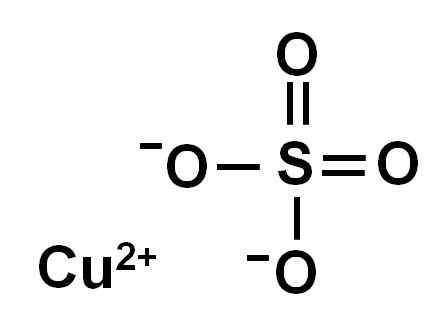 Siarczan miedzi joniki (II). Autor: Marilú Stea.
Siarczan miedzi joniki (II). Autor: Marilú Stea. Z powodu utraty dwóch elektronów jon miedzi (II) ma następującą konformację elektroniczną:
1s2 2s2 2 p6 3s2 3p6 3d9
Można zauważyć, że orbital ma 3d niekompletne (ma 9 elektronów zamiast 10).
Nomenklatura
- Bezwodny siarczan miedzi
- Siarczan miedzi (ii)
- Siarczan miedzi
Nieruchomości
Stan fizyczny
Zielone białe stałe lub kryształowe.
Waga molekularna
159,61 g/mol
Temperatura topnienia
Przy 560 °.
Gęstość
3,60 g/cm3
Rozpuszczalność
22 g/100 g wody w 25 ° C. Nierozpuszczalne w etanolu.
Właściwości chemiczne
Gdy jest poddawany wilgoci powietrza poniżej 30 ° C4 •5h2ALBO.
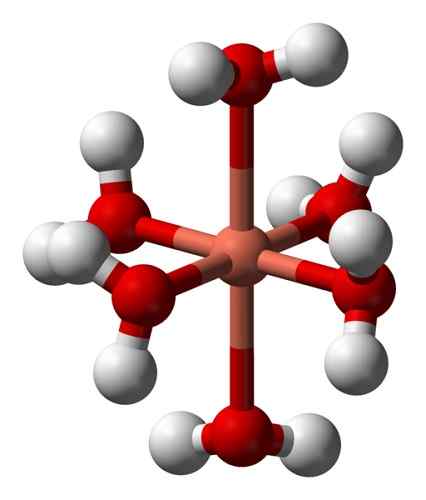
Jego wodne roztwory są niebieskie ze względu na utworzenie jonu heksakuocobre (ii) [cu (h (h (h (h2ALBO)6]2+ który wytwarza takie zabarwienie. W tym jonie dwie cząsteczki wody są dalej od atomu metalicznego niż pozostałe cztery.
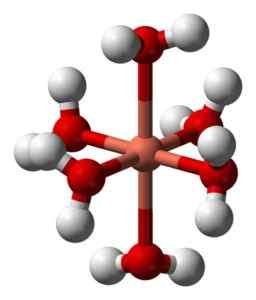 Zdeformowana struktura jonu heksaakuocobre (II) [cu (h (h2ALBO)6]2+. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Zdeformowana struktura jonu heksaakuocobre (II) [cu (h (h2ALBO)6]2+. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. Wynika to z tak zwanego efektu Jahna-Tellera, który przewiduje, że ten typ systemów doświadcza zniekształceń spowodowanych faktem, że Cu2+ Ma strukturę elektroniczną, która kończy się w D9, to znaczy niekompletna orbital (byłoby to kompletne, gdyby to było D10).
Może ci służyć: wodorotlenek wapnia (CA (OH) 2): Struktura, właściwości, uzyskiwanie, zastosowaniaJeśli dodaje się amoniak (NH3) Rozwiązania te powstają, w których NH3 Cząsteczki wody są sukcesywnie wypierające. Są one utworzone na przykład z [cu (NH3) (H2ALBO)5]2+ Aż [cu (NH3)4(H2ALBO)2]2+.
Kiedy cuso4 Jest ogrzewany do rozkładu emituje toksyczne gazy i staje się tlenkiem miedzianym.
Uzyskanie
Bezwodny siarczan miedzi można uzyskać przez całkowite odwodnienie związku pentahydratu, który osiąga się przez ogrzewanie go, aż cząsteczki wody odparowują.
Cuso4 •5h2O + ciepło → cuo4 + 5 godzin2Lub ↑
Związek pentahydratu jest niebieski, więc woda cuso jest uzyskiwana podczas utraty wody krystalizacji4 Biały bezwodny.
Aplikacje
Niektóre z jego zastosowań pokrywają się z zastosowaniem związku pentahydrata. Inne są specyficzne dla substancji bezwodnej.
Jako środek przeciwbakteryjny
Ma potencjał jako środek przeciwdrobnoustrojowy. Był używany od tysięcy lat, nawet w kulturach Ameryki Południowej i Ameryki Środkowej, aby zapobiec infekcji ran przez gazę zaimpregnowaną w roztworze tego związku.
Szacuje się, że w mechanizmie jego aktywności przeciwbakteryjnej jony cu2+ Tworzą chelaty z enzymami, które są kluczowe dla funkcji komórkowych bakterii, dezaktywując je. Indukują również tworzenie rodników hydroksylowych OH •, które uszkadzają błony bakterii i ich DNA.
 Cuso4 Może działać przeciwko niektórym patogennym bakteriom. Autor: Gerd Altmann. Źródło: Pixabay.
Cuso4 Może działać przeciwko niektórym patogennym bakteriom. Autor: Gerd Altmann. Źródło: Pixabay. Ostatnio doniesiono, że CUSO ślady4 Mogą zwiększyć aktywność przeciwdrobnoustrojową naturalnych produktów bogatych w polifenole, takie jak ekstrakty granatowe i infuzje niektórych rodzajów roślin herbaty.
W aplikacjach weterynaryjnych
Jest stosowany jako antyseptyczny i ściągający dla błon śluzowych oraz do leczenia zewnętrznego zapalenia spojówek i zapalenia ucha środkowego. Służy do wykonywania kąpieli terapeutycznych lub profilaktycznych, aby uniknąć zgnilizny bydła, owce i innych ssaków.
 Cuo Wodne roztwory4 Służą do leczenia otworów bydła. Autorzy: Ingrid und Stefan Melichar. Źródło: Pixabay.
Cuo Wodne roztwory4 Służą do leczenia otworów bydła. Autorzy: Ingrid und Stefan Melichar. Źródło: Pixabay. Służy jako środek żrący dla mas martwicy w kończynach bydła, wrzodów zapalenia jamy ustnej i tkanki granulowanej. Ma zastosowanie jako grzybobójstwo w leczeniu barwnika i chorób spowodowanych grzybami skóry.
Jest również stosowany jako Emético (agent do wywołania wymiotów) u świń, psów i kotów; Jako antydiarrotowa ściągająca dla cieląt i kontroli moniliasis jelitowych w drobiu i Turkey Trichomoniasis.
Jako suplement karmy dla zwierząt
Siarczan miedzi był używany jako suplement w bardzo małych ilościach do karmienia bydła, świń i drobiu. Służy do leczenia niedoboru miedzi w przeżuwaczy. W przypadku świń i ptaków jest stosowany jako stymulant wzrostu.
Może ci służyć: chromatogramMiedź została zidentyfikowana jako niezbędna do biosyntezy hemoglobiny u ssaków, struktura sercowo -naczyniowa, synteza kolagenu kostnego, układów enzymatycznych i reprodukcji.
Jak wspomniano w poprzednim rozdziale, można go również dostarczyć jako leki na kontrolę choroby. Jednak poziomy suplementacji i/lub leków muszą być monitorowane ostrożnie.
 Nadmiar siarczanu miedzi w diecie może mieć wpływ na ich dieta nadmiar siarczanu miedzi. Autor: Pexels. Źródło: Pixabay.
Nadmiar siarczanu miedzi w diecie może mieć wpływ na ich dieta nadmiar siarczanu miedzi. Autor: Pexels. Źródło: Pixabay. Z pewnej ilości, która zależy od każdego gatunku, może zmniejszyć wzrost, utratę apetytu i wagę, uszkodzenie niektórych narządów, a nawet śmierć zwierząt.
Na przykład u kurczaków suplementacja o 0,2% lub więcej zmniejsza spożycie ich żywności z wynikającymi z nich utraty masy ciała, zmniejszoną produkcją jaj i grubością ich skór.
W zastosowaniach rolniczych
W systemach produkcji ekologicznej nie wolno używać syntetycznych fungicydów, akceptowane są tylko produkty miedzi i siarki, takie jak siarczan miedzi.
Na przykład niektóre grzyby atakujące rośliny jabłkowe, takie jak Venturia inaequalis, są wyeliminowane za pomocą tego związku. Uważa się, że prawdopodobnie jony cu2+ Są w stanie wejść do zarodników grzybów, denaturalizować białka i zablokować kilka enzymów.
 Siarczan miedzi służy do walki z grzybami, które atakują jabłka. Algirdas w Lt.Wikipedia / domena publiczna. Źródło: Wikimedia Commons.
Siarczan miedzi służy do walki z grzybami, które atakują jabłka. Algirdas w Lt.Wikipedia / domena publiczna. Źródło: Wikimedia Commons. Znaczenie miedzi w roślinach
Element miedzi jest ważny w procesach fizjologicznych roślin, takich jak fotosynteza, oddychanie i obrona przed przeciwutleniaczami. Zarówno niedobór tego elementu, jak i jego nadmiar generują reaktywne gatunki natlenione.
Odstęp stężenia miedzi dla optymalnego wzrostu i rozwoju roślin jest bardzo wąski.
Niekorzystny wpływ na rolnictwo
Gdy ten produkt jest nadmiernie stosowany w działaniach rolniczych, może być fitotoksyczny, powodować przedwczesne rozwój owoców.
Ponadto miedź gromadzi się na ziemi i jest toksyczna wobec mikroorganizmów i dżdżownic. To jest sprzeczne z koncepcją rolnictwa ekologicznego.
 Chociaż cuso4 Jest stosowany w rolnictwie ekologicznym może być szkodliwy dla robaków Ziemi. Autor: Patricia Maine DeGrave. Źródło: Pixabay.
Chociaż cuso4 Jest stosowany w rolnictwie ekologicznym może być szkodliwy dla robaków Ziemi. Autor: Patricia Maine DeGrave. Źródło: Pixabay. O reakcjach chemicznych
Cuso4 Bezwodnik służy jako katalizator kilku reakcji związków organicznych karbonyl. Dzięki temu związku reakcje można wykonać w miękkich warunkach.
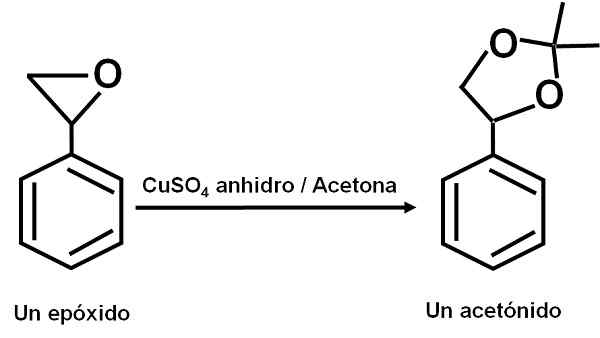 Przykład reakcji, w której CUSO4 bezwodne działa jak katalizator. Autor: Marilú Stea.
Przykład reakcji, w której CUSO4 bezwodne działa jak katalizator. Autor: Marilú Stea. Doniesiono również, że jego działanie katalityczne pozwala na odwodnienie alkoholi wtórnych, trzeciorzędowych, benzylowych i aliliowych do odpowiednich olefin. Reakcja odbywa się w bardzo prosty sposób.
Może ci służyć: annetolCzysty alkohol jest ogrzewany razem z cuso4 bezwodne w temperaturze 100-160 ° C przez czas 0,5-1,5 godziny. Zatem występuje odwodnienie alkoholu i olefiny, czyste destyluje od mieszaniny reakcyjnej.
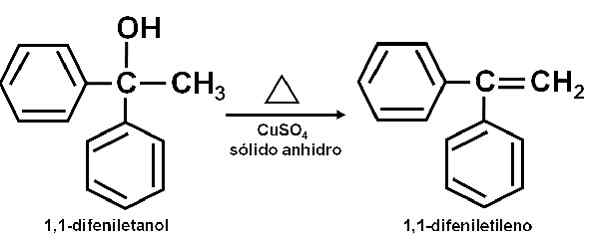 Odwodnienie alkoholu dla siarczanu miedzi (ii) bezwodnego. Autor: Marilú Stea.
Odwodnienie alkoholu dla siarczanu miedzi (ii) bezwodnego. Autor: Marilú Stea. Jako środek odwodniający
Związek ten jest stosowany w laboratoriach chemii jako wysuszony. Służy do odwodnienia płynów organicznych, takich jak rozpuszczalniki. Wchłaniaj wodę tworzącą związek pentahydrate cuo4 •5h2ALBO.
 Kiedy cuso4 Biała anhydro wchłania woda staje się niebieskim związkiem pentahydratowym4.5h2ALBO. Crystal Titan/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Kiedy cuso4 Biała anhydro wchłania woda staje się niebieskim związkiem pentahydratowym4.5h2ALBO. Crystal Titan/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Poprawić polimery
Cuso4 Anhydro zastosowano do poprawy właściwości niektórych polimerów, a jednocześnie umożliwić im recykling.
Na przykład cząstki związku acetonowego zmieszano z gumą akrylonitrylu-butadiena w specjalnym młynie, próbując wytwarzać cząstki cuso4 Bądź bardzo mały.
Siarczan miedziowy poprawia punkty unii polimerowej tworząc mieszaninę o wysokiej oporności, twardości i zaskakującej elastyczności.
W wycofanych aplikacjach terapeutycznych
W przeszłości stosowano roztwory siarczanu miedzi do mycia żołądka, gdy ktoś doznał zatrucia białego fosforu. Jednak roztwór szybko poruszył się, aby uniknąć zatrucia miedzianego.
Roztwory tego związku zastosowano również wraz z innymi substancjami do miejscowych oparzeń w skórze przez fosfor.
Czasami służyli w niektórych formach żywienia.
Niektóre płyny dla egzemy, impetigo i intertrigo zawierały CUO4. Roztwory zastosowano jako ściągające w infekcjach oczu. Czasami kryształy nakładano bezpośrednio na oparzenia lub wrzody.
Wszystkie te zastosowania nie są już tworzone z powodu toksyczności, która może indukować nadmiar związku.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Siarczan miedzi. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Montag, J. i in. (2006). Badanie in vitro na temat Venturia inaequalis. J. Rolnictwo. Żywność Chem. 2006, 54, 893-899. Link odzyskał.Skoczek.com.
- Holloway, a.C. i in. (2011). Zwiększenie aktywności przeciwdrobnoustrojowej całej i subfrakcjonowanej białej herbaty przez uzależnienie siarczanu miedzi (II) i witaminy C przeciw Staphylococcus aureus; Do podejścia mechanistycznego. BMC uzupełnia altern Med 11, 115 (2011). Pobrano z BMCPLEMENTEDTHERAPIES.Biomedcentral.com.
- Sanz, a. i in. (2018). Mechanizm pobierania miedzi Thalian Arabidopsis Transportery COPT High -Copt. Protoplasma 256, 161-170 (2019). Link odzyskał.Skoczek.com.
- Griminger, str. (1977). Wpływ siarczanu miedzi na produkcję jaj i grubość skorupy. Poultry Science 56: 359-351, 1977. Odzyskane z akademickiego.OUP.com.
- Hanzlik, r.P. I Leinwetter, m. (1978). Reakcja epoksydów i związków karbonylowych katalizowanych przez bezwodny siarczan miedzi. J. Org. Chem., Tom.43, nie.3, 1978. Odzyskane z pubów.ACS.org.
- Okonkwo, a.C. i in. (1979). Wymagania miedzi w przypadku diety oczyszczonej dla niemowląt świni. The Journal of Nutrition, tom 109, wydanie 6, czerwiec 1979, strony 939-948. Odzyskane z akademickiego.OUP.com.
- Hoffman, r.V. i in. (1979). Bezwodna miedź (ii) siarczan: efektywność. J. Org. Chem., 1980, 45, 917-919. Odzyskane z pubów.ACS.org.
- Shao, c. i in. (2018). Poprawa wytrzymałości na rozciąganie kompozytów gumy akrylonitrylu-butadienu/bezwodnego siarczanu miedzianego przygotowywane przez koordynację sieciowanie. Polim. Byk. 76, 1435-1452 (2019). Link odzyskał.Skoczek.com.
- Betts, j.W. i in. (2018). Nowe przeciwbakteryjne: alternatywy dla tradycyjnych antybiotyków. Miedź. W postępach w fizjologii drobnoustrojów. Odzyskane z naukowym.com
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Witryny Google. Wykonaj bezwodny siarczan miedzi. W paradoksie chemia domowa. Odzyskane z witryn.Google.com.

