Estry
- 3048
- 834
- Estera Wojtkowiak
 Estery to związki organiczne, które mają składnik kwasu karboksylowego i inny alkohol
Estery to związki organiczne, które mają składnik kwasu karboksylowego i inny alkohol Co to są estry?
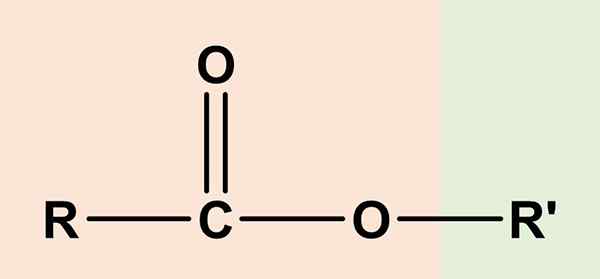
estry Są to związki organiczne, które mają składnik kwasu karboksylowego i inny alkohol. Jego ogólna formuła chemiczna to RCO2R' lub RCOOR'. Prawa strona, RCOO, odpowiada grupie karboksylowej, podczas gdy prawa, lub' To jest alkohol. Obaj dzielą atom tlenu i dzielą pewne podobieństwo z eterami (ROR).
Z tego powodu octan etylu, ch3Cooch2Ch3, Najprostszy z estrów został uznany za Eter kwasu octowego lub octu, I stamtąd etymologiczne pochodzenie nazwy „ester”. Tak, że ester składał się z zastąpienia kwaśnego wodoru grupy COOH, z wypożyczalnią alkoholu od alkoholu.
Gdzie są estry?
Z gleb chemii organicznej istnieje wiele naturalnych źródeł. Przyjemny zapach owoców, takich jak banany, gruszki i jabłka, jest wynikiem interakcji estrów z wieloma innymi komponentami. Znajdują się również w postaci trójglicerydów w olejach lub tłuszczach.
Nasze organizm produkuje trójglicerydy z kwasów tłuszczowych, które mają długie sieciowane łańcuchy i alkohol glicerolu. To, co odróżnia niektóre estry od innych, leży zarówno w r, łańcuchu składnika kwasu, jak w r ', komponencie alkoholowym.
Ester o niskiej masie cząsteczkowej musi mieć kilka węgli w R i R ', podczas gdy inne, takie jak woski, mają wiele węgli, szczególnie w składniku alkoholowym R', a zatem o wysokiej masie cząsteczkowej.
Jednak nie wszystkie estry są ściśle organiczne. Jeśli atom grupy węglowej grupy karbonylowej zostanie zastąpiony jednym z fosforu, wówczas RPOOR będzie miał ”. Jest to znane jako ester fosforanowy i ma kluczowe znaczenie w strukturze DNA.
Zatem, ilekroć atom może być skutecznie powiązany z węglem lub tlenem, takim jak siarka (rsoor), może w konsekwencji tworzyć ester nieorganiczny.
Właściwości Estres
Estry nie są kwasami ani alkoholem, więc nie zachowują się jako takie. Na przykład jego temperatury topnienia i wrzenia są niższe niż te o podobnych masach cząsteczkowych, ale bliżej wartości do wartości aldehydów i ketonów.
Kwas butanowy, cho3Ch2Ch2COOH, ma temperaturę wrzenia 164º C, podczas gdy octan etylu, CH3Cooch2Ch3, z 77.1st c.
Oprócz ostatniego przykładu, temperatury wrzenia 2-metylobutanu3CH (rozdz3) Ch2Ch3, Octan metylu, Cho3Cooch3, i 2-butanol, cho3,CH (OH) CH2Ch3, Są następujące: 28, 57 i 99º C. Trzy związki mają masę cząsteczkową 72 i 74 g/mol.
Estry pesos o niskiej molekularnej są zwykle lotne i mają przyjemne zapachy, dlatego ich treść w owocach daje im swoje rodzinne zapachy. Z drugiej strony, gdy ich masy cząsteczkowe są wysokie, są one bezbarwne i bezwonne krystaliczne substancje stałe lub w zależności od ich struktury, mogą wykazywać charakterystykę tłustej.
Rozpuszczalność wody
Kwasy karboksylowe i alkohole są zwykle rozpuszczalne w wodzie, chyba że mają wysoki charakter hydrofobowy w swoich strukturach molekularnych. To samo dotyczy estrów. Gdy r lub r 'są krótkimi łańcuchami, ester może oddziaływać z cząsteczkami wody przez dipol-dipolo i siły sił londyńskich.
Może ci służyć: związek chemicznyWynika to z faktu, że estry są akceptorami mostu wodorowego. Jak? Za dwa atomy tlenu RCOOor '. Cząsteczki wody mogą tworzyć mosty wodorowe z dowolnym z tych tlenu. Ale kiedy łańcuchy R lub R są bardzo długie, odpychają wodę w swoim otoczeniu, co uniemożliwia rozwiązanie.
Oczywistym przykładem tego występuje w przypadku estrów trójglicerydowych. Ich łańcuchy boczne są długie i sprawiają, że oleje i tłuszcze są nierozpuszczalne w wodzie, chyba że mają kontakt z mniej polarnym rozpuszczalnikiem, bardziej związanym z tymi łańcuchami.
Reakcja hydrolizy
Estery mogą również reagować z cząsteczkami wody w tak zwanej reakcji hydrolizy. Wymagają jednak kwasu lub podstawowego środowiska, aby promować mechanizm wspomnianej reakcji:
Rcoor ' + H2ALBO RCOOh + R'OH
(Kwasowa połowa)
Cząsteczka wody jest dodawana do grupy karbonylowej, C = O. Hydroliza kwasu podsumowano w wymianie każdego R 'składnika alkoholowego przez OH z wody. Zwróć również uwagę, w jaki sposób ester „pęka” w swoich dwóch składnikach: kwas karboksylowy, RCOOH i R'OH Alkohol.
Rcoor ' + Oh- => RCOALBO- + R'OH
(Podstawowe medium)
Gdy hydroliza jest wykonywana w podstawowym pożywce, zachodzi nieodwracalna reakcja znana jako Saponifikacja. Jest to bardzo zatrudnione i jest kamieniem węgielnym w opracowaniu mydła rzemieślniczego lub przemysłowego.
RCOO- Jest to anion karboksylanowy, stabilny, który jest powiązany elektrostatycznie z dominującym kationem pośrodku.
Jeśli zastosowaną podstawą jest NaOH, sól powstaje. Gdy ester jest trójglicerydem, który z definicji ma trzy łańcuchy R, powstają trzy sole kwasu tłuszczowego, RCOone i alkohol glicerolu.
Reakcja redukcji
Estry to silnie utlenione związki. Oznacza to, że ma kilka kowalencyjnych wiązań z tlenem. Wyeliminując wiązania C-O, następuje przerwa, która kończy się oddzieleniem kwasowych i alkoholowych składników; Co więcej, kwas jest redukowany do mniej utlenionego sposobu na alkohol:
Rcoor '=> rCH2OH + R'OH
To jest reakcja redukcji. Potrzebny jest silny środek redukujący, taki jak lit i wodorek aluminiowy, lialh4, i kwaśnego pożywki, która promuje migrację elektronów. Alkohole są najmniejszymi formami, to znaczy te, które mają mniej kowalencyjne wiązania z tlenem (tylko jeden: C-OH).
Dwa alkohole, RCH2Oh + r'oh, pochodzą z dwóch odpowiednich łańcuchów oryginalnego ester rcoor ''. Jest to metoda syntezy alkoholi o wartości dodanej z jej estrów.
Na przykład, jeśli chcesz wyprodukować alkohol egzotycznych estrów, byłaby to dobra trasa do tego celu.
Reakcja transterifikacji
Estry można przekształcić w inne, jeśli reagują na kwaśne lub podstawowe pożywki z alkoholem:
Rcoor ' + R "Och RCOLub " + R'OH
Struktura estru
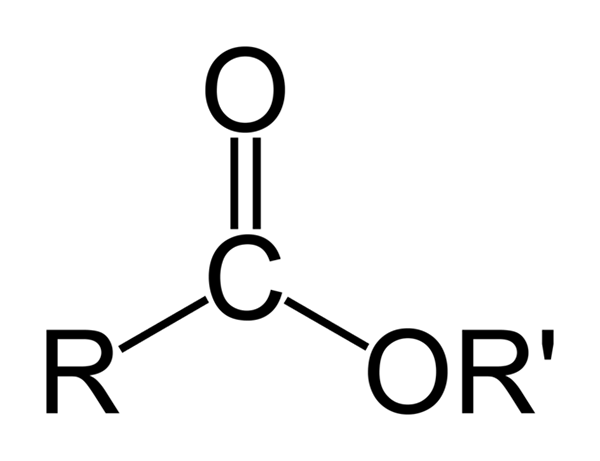 Ogólna struktura chemiczna estrów organicznych. Źródło: Ben Mills przez Wikipedia
Ogólna struktura chemiczna estrów organicznych. Źródło: Ben Mills przez Wikipedia Najwyższy obraz reprezentuje ogólną strukturę wszystkich estrów organicznych. Zauważ, że R, grupa karbonylowa C = O i OR, tworzą płaski trójkąt, iloczyn hybrydyzacji SP2 centralnego atomu węgla. Jednak inne atomy mogą przyjmować inne geometrie, a ich struktury zależą od wewnętrznej natury r lub r '.
Może ci służyć: azotany: właściwości, struktura, nomenklatura, szkolenieJeśli R lub R 'są prostymi łańcuchami Alqulicas, na przykład typu (wybierz2)NCh3, Będziesz wyglądać zygzagueada w kosmosie. Tak jest w przypadku Pentilo Butanoat3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3.
Ale w którymkolwiek z węgla tych łańcuchów można znaleźć gałąź lub nienasycenie (C = C, C≡C), co zmodyfikowałoby globalną strukturę estru. I z tego powodu jego właściwości fizyczne, takie jak rozpuszczalność i punkty wrzenia i fuzji, różnią się w zależności od każdego związku.
Na przykład, nienasycone tłuszcze mają podwójne połączenia w swoich łańcuchach R, które negatywnie wpływają na interakcje międzycząsteczkowe. W rezultacie ich punkty topnienia opadają, aż będą płynne lub oleje, w temperaturze pokojowej.
Akceptor mostu wodoru
Chociaż obraz szkieletu estrów wyróżnia się bardziej, to łańcuchy R i R odpowiedzialne za różnorodność w ich strukturach.
Jednak strukturalna charakterystyka estrów jest zasłużona dla trójkąta: są one owijanami mostu wodorowego. Jak? Przez tlen grup karbonylowych i alkoholowych (-or ').
Mają one pary wolnych elektronów, które mogą przyciągnąć częściowo dodatnie atomy wodoru cząsteczek wody.
Dlatego jest to specjalny rodzaj interakcji dipol-dipol. Cząsteczki wody zbliżają się do estru (jeśli łańcuchy R O r 'nie zapobiegają, a mosty powstają C = O-H2Lub lub och2-LUB '.
Nomenklatura estrów
Aby odpowiednio nazwać ester, jest to konieczne. Również każda możliwa gałąź, podstawnik lub nienasycenie.
Gdy to się stanie, nazwa R 'grupy alcoxekdowej -lub sufiks jest dodawany -ILO, Podczas gdy łańcuch grupy RARBOXILO -COOR R, sufiks -Ato. Najpierw wspomniany jest sekcja R, a następnie słowo „z”, a następnie nazwa r „sekcji”.
Na przykład Cho3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3 Ma pięć węgli po prawej stronie, to znaczy są tymi, które odpowiadają R '. A po lewej stronie znajdują się cztery atomy węgla (w tym grupa karbonylowa C = O).
Dlatego R 'jest grupą Pentil, a Butan R A (dla w tym karbonyl i rozważanie łańcucha głównego). Następnie, aby nadać nazwę związku, wystarczy dodać odpowiednie sufiksy i nazwać je we właściwej kolejności: ButanAto pentILO.
Jak nazwać następujący związek: CH3Ch2COOC (rozdz3)3? Łańcuch -c (cho3)3 odpowiada podstawowi alquilicznego prosto-butylu. Ponieważ lewa strona ma trzy węgle, jest to „propan”. Nazywa się zatem: PropanAto tert-aleILO.
Jak powstają estry?
Estryfikacja
Istnieje wiele dróg do syntezy estru, z których niektóre mogą być nawet nowatorskie. Jednak wszyscy zbiegają się w fakcie, że musi być utworzony trójkąt obrazu struktury, to znaczy łącze Co-O. W tym celu musi zaczynać się od związku, który wcześniej ma grupę karbonylową: jako kwas karboksylowy.
I co należy połączyć kwas karboksylowy? Do alkoholu, w przeciwnym razie nie miałby elementu alkoholowego, który charakteryzuje estry. Jednak kwasy karboksylowe wymagają ciepła i kwasowości, aby umożliwić mechanizm reakcji. Poniższe równanie chemiczne reprezentuje powyższe:
Może ci służyć: aluminiowy wodorek (ALH3): struktura, właściwości, użyciaRcooh + r'oh rcoor ' + h2ALBO
(Kwasowa połowa)
To jest znane jako Estryfikacja.
Na przykład kwasy tłuszczowe mogą esteryfikować za pomocą metanolu, Cho3Och, aby zastąpić ich kwasy grupami metylowymi, więc tę reakcję można również uznać za metylacja. Jest to ważny krok przy określaniu profilu kwasu tłuszczowego niektórych olejków lub tłuszczów.
Estery z chlorków kwasowych
Innym sposobem syntezy estrów są chlorki acylu, RCOCL. W nich, zamiast zastępować grupę hydroksylową OH, atom CL jest zastąpiony:
Rcocl + r'oh => rcoor ' + hcl
I w przeciwieństwie do steryfikacji kwasu karboksylowego, woda nie jest uwalniana, ale kwas solny.
Inne metody są dostępne w świecie chemii organicznej, takie jak utlenianie Baeyer-Villiger, który wykorzystuje kwasy peroksypsy (RCOOOH).
Estres używa
 Estery są używane do różnych rzeczy, takich jak wytwarzanie świec
Estery są używane do różnych rzeczy, takich jak wytwarzanie świec Wśród głównych zastosowań estrów są:
- W świecach lub świecach opracowywania, takich jak doskonały obraz. W tym celu używane są bardzo długie estry łańcucha bocznego.
- Jako konserwatyki medycyny lub jedzenie. Wynika to z działania parabenów, które są niczym więcej niż esterami kwasu para-hydroksybenzoinowego. Chociaż zachowują jakość produktu, istnieją badania, które kwestionują jego pozytywny wpływ na ciało.
- Służą do produkcji sztucznych zapachów, które naśladują zapach i smak wielu owoców lub kwiatów. Tak aby estry były obecne w smakołykach, lodach, perfumach, kosmetykach, mydłach, szamponach, między innymi produktami komercyjnymi, które zasługują na aromaty lub atrakcyjne smaki.
- Estry mogą również zapewnić pozytywny efekt farmakologiczny. Z tego powodu przemysł farmaceutyczny poświęcił się syntetyzacji estrów pochodzących z kwasów obecnych w organizmie w celu oceny możliwej poprawy leczenia chorób. Aspiryna jest jednym z najprostszych przykładów tych estrów.
- Estry ciekłe, takie jak octan etylu, są odpowiednimi rozpuszczalnikami dla niektórych rodzajów polimerów, takich jak nitroceluloza i szeroki zakres żywic.
Przykłady estrów
Niektóre dodatkowe przykłady estrów są następujące:
- Butanato de Pentilo, CH3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3, który pachnie jak albicoque i gruszki.
- Octan winylowy, Cho3Cooch2= Ch2, od którego występuje polimer polimeru poliwinylu.
- Isopentilo Pentanoato, CH3Ch2Ch2Ch2Cooch2Ch2CH (rozdz3)2, który naśladuje smak jabłek.
- Etyl Propanoan, CH3Ch2Cooch2Ch3.
- Propyl Metanoate, HCOOCH2Ch2Ch3.
Bibliografia
- T.W. Graham Solomons, Craight B. Fryhle. Chemia organiczna. (Dziesiąta edycja, str. 797-802, 820) Wiley Plus.
- Carey, f. DO. Chemia organiczna (2006) Wydanie szóste. MC Graw Hill Editorial-
- Chemia librettexts. Nomenklatura ESERS. Odzyskane z: chem.Librettexts.org
- Admin. (19 września 2015 r.). Estry: jego chemiczny charakter, właściwości i zastosowania. Zaczerpnięte z: czystego chemicznego.com
- Chemia organiczna w naszym życiu codziennym. (9 marca 2014). Jakie są zastosowania estrów? Pobrano z: Gen2Chemistassignment.Webly.com
- Chemika.Net (2018). Przykłady estrów. Odzyskane z: chemika.internet
- Paz María de Lourdes Cornejo Arteaga. Główne zastosowania estrów. Zaczerpnięte z: Zeah.Edu.MX
- Jim Clark. (Styczeń 2016). Estry wprowadzające. Zaczerpnięte z: chemguide.współ.Wielka Brytania

