Rozwiązania amortyzujące

- 1588
- 331
- Gabriela Łuczak
Wyjaśniamy, jakie są rozwiązania tłumienia, ich właściwości, komponenty, typy i podajemy kilka przykładów
 Roztwory pochłaniające wstrząsy regulują pH wokół określonej wartości
Roztwory pochłaniające wstrząsy regulują pH wokół określonej wartości Co to są rozwiązania tłumienia?
Rozwiązania amortyzujące, Zwane także bufory, pH lub bufory regulatory, są roztworami wodnymi utworzonymi przez słaby kwas i jego koniugatową zasadę lub słabą zasadę i sprzężony kwas.
Nazywa się je roztworami amortyzującymi, ponieważ mają zdolność do amortyzacji zmiany pH po dodaniu kwasów lub zasad w małych ilościach, nawet jeśli są to silne kwasy lub zasady.
Roztwory amortyzatora są bardzo przydatne, ponieważ pozwalają na stałe pH. Istnieje wiele reakcji chemicznych, które wymagają określonego i stałego pH, aby dobrze funkcjonować.
Właściwości roztworów Morpiainary
Są to roztwory wodne
Zarówno koncepcja pH, jak i skala pH mają sens tylko w roztworach wodnych, więc wszystkie bufory lub roztwory tłumienia są przygotowywane w wodzie.
Jego działanie opiera się na równowadze kwasowo-zasadowej i zasadach Le Chatlier
Bufory oparte są na odwracalnych reakcjach dysocjacji kwasu/zasady, które są w równowadze. Dodając do środowiska silne kwasy lub zasady, równowaga ta jest zaburzona, więc system reaguje na przeciwdziałanie zakłóceniu, zgodnie z zasadami le catelier. W ten sposób buforom udaje się złagodzić wielkie zmiany w pH.
Twoje pH można łatwo obliczyć za pomocą równania Henderson-Haselbalch
Niezależnie od rodzaju roztworu absorbera wstrząsu, jego pH zarówno przed, jak i po dodaniu niewielkich ilości silnych kwasów lub zasad, można go obliczyć za pomocą równania Henderson-Hohaselbalch:
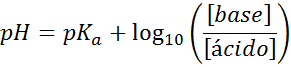
Gdzie [zasada] odnosi się do stężenia molowego zasady (lub soli podstawy sprzężonej), a [kwas] odnosi się do stężenia molowego kwasu (lub soli kwasu sprzężonego).
Może ci służyć: elastyczne materiałySą w stanie częściowo zneutralizować zarówno kwasy, jak i zasady
Roztwory tłumienia składają się z podstawowej substancji i substancji kwasowej, która może zneutralizować odpowiednio zasady i kwasy. Z tego powodu mogą amortyzować pH po dodaniu zarówno silnych kwasów, jak i silnych zasad.
Jego działanie zależy od temperatury
PH roztworu buforowego zależy od kwasowości lub podstawowej stałej kwasu lub słabej zasady, którą zawiera. Ta stała zależy od temperatury, więc działanie tych roztworów zależy również od temperatury.
Im bardziej skoncentrowane, tym większa jego zdolność do amortyzacji lub regulacji pH
Zdolność tłumienia zależy od całkowitego stężenia roztworu jest większe niż końcowe stężenie kwasu lub silnej zasady, która jest dodawana. Z tego powodu im większe całkowite stężenie roztworu buforowego, tym większa jego zdolność do amortyzacji kwasów lub silnych zasad.
Składniki roztworu tłumiącego lub buforowego
Chemicznie roztwory tłumienia są tworzone tylko przez dwa komponenty. Składniki te mogą być słabym kwasem zmieszanym z solą z jej koniugatowej zasady lub słabą zasadą zmieszaną z solą z jego sprzężonego kwasu.
Istnieją dwa różne sposoby uzyskania tych komponentów w tym samym rozwiązaniu, jak zobaczymy poniżej:
1. Przygotowanie buforów mieszających roztwory swoich komponentów
Jest to najbardziej bezpośredni sposób na przygotowanie rozwiązania buforowego. W tym celu przygotowano oddzielne roztwory słabego kwasu (na przykład kwas octowy) i sól bazową sprzężoną (na przykład octan sodu)) oddzielne roztwory). Wtedy oba rozwiązania stopniowo mieszają się, aż pożądane pH.
Może ci służyć: jon amonium (NH4+): wzór, właściwości i zastosowania
- Rozwiązania są stopniowo mieszane, aż do pożądanego pH
2. Przygotowanie buforów przez częściową neutralizację roztworu słabego kwasu
W tym przypadku przygotowano słaby roztwór kwasowy z pożądanym stężeniem, a następnie wodorotlenek sodu lub potasu dodaje się stopniowo, aż do pożądanego pH.
Rodzaje rozwiązań buforowych
Roztwory amortyzatora można zaklasyfikować zgodnie z rodzajami posiadanych komponentów lub zgodnie z ich końcowym pH.
Według rodzajów komponentów:
- Słaby i sprzężony bufor podstawy: W takich przypadkach pH zależy od PKDo słabego kwasu.
- Słaby bufor zasadowy i sprzężony kwas: W takich przypadkach pH zależy od PKB słaby.
- Bufor soli kwasu poliprotycznego: W niektórych przypadkach zarówno rola słabego kwasu, jak i jego baza koniugatu są sole z częściowej neutralizacji kwasu, który ma kilka protonów, takich jak kwas siarkowy lub fosforowy.
Według jego ostatecznego pH:
W zależności od kwasowości lub podstawowej stałej roztwór bufora może regulować pH wokół różnych zakresów pH, co daje trzy rodzaje buforów:
- Bufory kwasowe: Czy te, które regulują pH wokół wartości niższych niż 7. Są przygotowywane ze słabymi kwasami, których PKDo być mniej niż 7 lub z słabymi podstawami, których PKB być większym niż 7.
- Bufory neutralne: Czy te, które regulują pH około 7. Zwykle składają się ze słabych kwasów lub zasad, które mają PKDo lub PKB blisko 7.
- Bufory alkaliczne: Czy te, które regulują pH wokół wartości większych niż 7. Są przygotowywane ze słabymi kwasami, których PKDo być większe niż 7 lub z słabymi podstawami, których PKB jest mniej niż 7.
Przykłady buforów lub rozwiązań tłumienia
Bufor kwasu octowego/octan sodu
Jest to bufor słabego kwasu (kwas octowy) i sól jego koniugatowej zasady (octan sodu). Bilans i jego stała równowagi to:
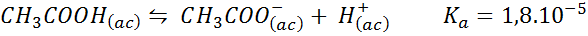
Ten bufor reguluje pH wokół 4,74.
Bufor amoniaku/chlorek amonu
Jest to słaby bufor podstawy (amoniak lub wodorotlenek amonu) i sól jego sprzężonego kwasu (chlorek amonu). Bilans i jego stała równowagi to:
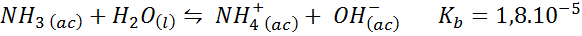
To jest bufor alkaliczny, który reguluje pH wokół 9.26.
Bufor bisulfate/siarczanowy
W tym przypadku jon nieporządny odtwarza papier słabego kwasu, którego koniugatą jest jon siarczanu. Równowaga to:
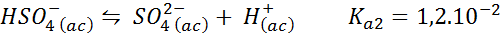
Jest to roztworze zakłócające kwas, który reguluje pH wokół 3.05.
Bufor kwasu/wodorowęglan
Jest to jeden z najważniejszych systemów regulacji pH we naszej krwi. Reakcja to: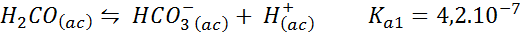
Ten bufor reguluje pH wokół 6.38.
Fosforan/fosforan wodoru buforu dihydrogenu
Jest to jeden z najczęściej stosowanych systemów regulacji pH w biologii i biochemii, ponieważ pozwala ono regulować pH bardzo blisko fizjologicznego pH, do którego występuje większość reakcji chemicznych w komórkach. Reakcja to:
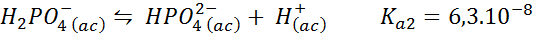
Ten bufor reguluje pH wokół 7.20.

