Rozwiązanie hipertoniczne
- 4210
- 1287
- Matylda Duda
Wyjaśniamy, jakie są roztwory hipertoniczne, ich cechy, jakie są zastosowanie, różnice z hipotoniką i podajemy kilka przykładów
Wielu będzie zaskoczonych, wiedząc, że sposób, w jaki rośliny pochłania wodę przez swoje korzenie i sposób, w jaki palce rąk są pomarszczone podczas kąpieli w wodzie morskiej, są ściśle powiązane.
Obie rzeczy dzieją się dzięki istnianiu membrany, która funkcjonuje jako filtr, oraz hipertoniczne rozwiązanie, które dosłownie wysysa wodę. Ale jakie jest roztwór hipertoniczny?
W tym artykule zostanie udzielone na to pytanie, a najbardziej odpowiednie cechy roztworów hipertonicznych zostaną również przedstawione, po co są one odróżniające od innych rodzajów rozwiązań i niektórych przykładów tego samego.
Co to jest roztwór hipertoniczny?
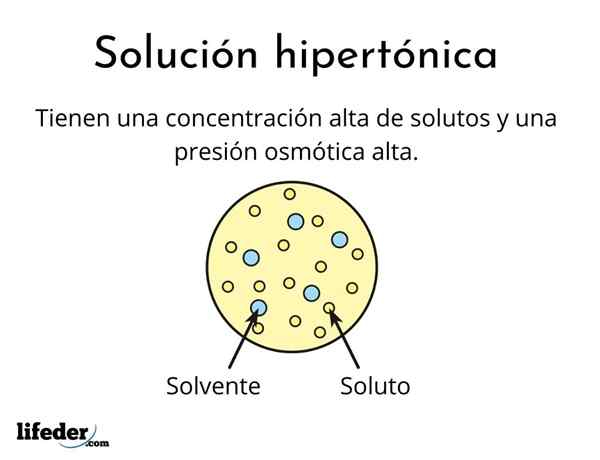
A Rozwiązanie hipertoniczne Jest to taki, który zawiera całkowite stężenie osmolarnie aktywnych substancji rozpuszczonych większe niż w innym roztworze odniesienia. Aktywne osmolowo oznacza, że substancje rozpuszczalne nie mogą przekroczyć specjalnego rodzaju membrany (podobnej do tkaniny), która działa jak sitko lub filtr, to znaczy, że woda przechodzi, a nie do cząstek substancji rozpuszczonej.
To wysokie stężenie substancji rozpuszczonych powoduje, że roztwory hipertoniczne mają wysokie ciśnienie osmotyczne. To ciśnienie jest tym, co praktycznie wysysa wodę przez błonę, która nazywa się osmozą.
Hipertoniczne słowo pochodzi od greckiego przedrostka hiper-, co oznacza „na„ on lub powyżej ”i„ tonach ”, co oznacza napięcie lub presję, więc hipertoniczny dosłownie oznacza„ że ma większe presję lub napięcie ”.
Należy pamiętać, że w biologii i medycynie, pod warunkiem, że mówi się o roztworze hipertonicznym, odnosi się do roztworu bardziej skoncentrowanego niż roztwór zawarty we krwi, który nazywa się osoczem krwi krwi.
Charakterystyka roztworów hipertonicznych
Rozwiązania hipertoniczne mają pewne podstawowe cechy:
Są tworzone przez rozpuszczalnik i przynajmniej jedną substancję rozpuszczoną
Żaden roztwór nie może być hipertoniczny, nawet więc jest bardzo skoncentrowany. Substancja substancji rozpuszczonej musi nie być w stanie przekroczyć membrany, podczas gdy woda musi być w stanie przepisać ją bez problemu, w przeciwnym razie ciśnienie osmotyczne nie jest generowane.
Mają wysokie stężenie substancji rozpuszczonych
To właśnie czyni je hipertonicznymi rozwiązaniami. Jak wspomniano chwilę temu, roztwory hipertoniczne są bardziej skoncentrowane niż krew.
Może ci służyć: destylacja ułamkowa: proces, sprzęt, aplikacje, przykładyMogą mieć różne kompozycje
Roztwór hipertoniczny może zawierać pojedynczą substancję substancji rozpuszczonej, takiej jak sól lub może zawierać mieszankę substancji rozpuszczonych, takich jak sole i cukry, na przykład.
Solutos mogą być jonowe, neutralne lub oba
Sprzedaż zawiera jony z ładunkami elektrycznymi, które nie pozwalają im przekraczać membrany, więc są małe. Inne substancje rozpuszczone nie mają jonów, ale są duże i grube i nie pasują do otworów.
Mają wysokie ciśnienie osmotyczne
Jak wspomniano powyżej, roztwory hipertoniczne mają ciśnienie osmotyczne większe niż krew.
Mogą odwodnić komórki
Roztwory hipertoniczne wydobywają wodę z komórek, pozostawiając je jako rodzynki. Dlatego nasze ręce i stopy są pomarszczone, gdy kąpiemy się na plaży.
Do czego są roztwory hipertoniczne?
Rozwiązania hipertoniczne mają wiele zastosowań w życiu codziennym, a także w medycynie. Niektóre z najczęstszych zastosowań to:
Są używane do przechowywania jedzenia
- Przykład: brzoskwinie w syropie nie gniją, ponieważ syrop ma dużo rozpuszczonego cukru i jest bardzo hipertonicznym roztworem. Przez komórki odwodnione roztwory hipertoniczne nie pozwalają na grzyby i bakterie w żywności, ponieważ umierają z pragnienia. To pozwala na przetrwanie żywności.
Służą do zmniejszenia stanu zapalnego
- Przykład: Gdy ktoś ma wypadek i uderza w głowę, w mózgu jest wiele razy zapalenie. Aby wyleczyć pacjenta, lekarze wstrzykują roztwór roztworu soli 7,5%. To rozwiązanie praktycznie ssie wodę, zmniejszając zapalenie w mózgu.
Służą do wymiany elektrolitów.
- Przykład: Sód jest elektrolitem, który musimy żyć, a kiedy pacjent ma niewielki sód we krwi, wstrzyknięto 7,5% roztwór soli fizjologicznej, aby uzupełnić utracony sód.
Są używane do jedzenia pozajelitowego
- Przykład: Gdy ludzie nie mogą jeść przez usta lub przez rurkę, karmią się roztworem hipertonicznym, który zawiera rodzaj cukru zwanego glukozą.
Różnice w roztworach hipotonicznych i izotonicznych
Tak jak istnieją roztwory hipertoniczne, istnieją również roztwory hipotoniczne i izotoniczne. Różnica między tymi ostatnimi a roztworami hipertonicznymi jest jego stężenie. Roztwory hipotoniczne to te, które są mniej skoncentrowane niż krew, a izotoniczne mają takie samo stężenie jak krew.
Na przykład czysta woda, ponieważ nie ma nic substancji rozpuszczonej, jest hipotoniczna, podczas gdy woda kokosowa ma sole i cukry o stężeniu prawie równym stężeniu krwi, więc jest izotoniczna.
Oprócz różnicowania przez ich stężenie, roztwory hiper, hipo i izotoniczne różnią się tym, jak wpływają na komórki.
Poniższy obraz pokazuje wpływ różnych rodzajów roztworów na czerwone krwinki (małe komórki, które sprawiają, że krew czerwona).
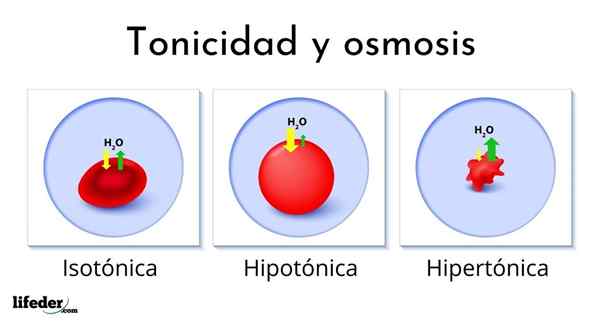
Jeśli czerwone krwinki zostaną wprowadzone do roztworu hipertonicznego, wydobywa wodę, odwodniąc je i pozostawiając pomarszczone jako przepustkę.
Z drugiej strony, jeśli zostaną wprowadzone do roztworu hipotonicznego, czerwone krwinki pochłaniają wodę i puchną, nawet pękając jak balon, który napełnia zbyt wiele. Wreszcie, jeśli zostaną wprowadzone do roztworu izotonicznego, woda wewnątrz i na zewnątrz czerwonych krwinek będzie równowaga, więc nic się nie dzieje.
Przykłady roztworów hipertonicznych
Syrop cukrowy
 Brzoskwinie w syropie
Brzoskwinie w syropie Syrop, w którym zachowane są brzoskwinie i inne owoce, zawiera bardzo wysokie stężenia cukru, więc jest to roztworem hipertoniczne.
Solanka
Solanka jest roztworem wody i soli o bardzo wysokich stężeniach od 3,5% do 25%, co może stać się prawie 30 razy bardziej skoncentrowane niż krew (to znaczy jest bardzo hipertoniczne).
Octu
Wspólny ocet jest roztworem hipertonicznym, ponieważ ma stężenie od 3% do 5% kwasu octowego. Redukcje octu balsamicznego są jeszcze bardziej skoncentrowane.
Może ci służyć: dimetyloamina ((CH3) 2nh): struktura, właściwości, zastosowania, ryzykoTa sama krew naszych żył, po dużo poceni.
Podczas ćwiczeń i pocenie ciała eliminuje wodę i sole, ale eliminuje więcej wody niż sole (pot jest hipotoniczny), więc krew koncentruje się i staje się hipertoniczna.
Woda morska
Woda morska zawiera wiele rozpuszczonych soli, z całkowitym stężeniem około 3,5%, co czyni ją hipertoniczną. Dlatego wodę morską marszczy nasze palce.
Słodzone napoje
Napoje cola i inne słodkie napoje mogą zawierać do 10% cukru, a także sole i inne substancje rozpuszczone o stężeniach większych niż krew.
5% roztworu dekstrozy i 0,45% chlorku sodu (D5 ½ ns)
Jest to przykład hipertonicznego rozwiązania, które służy do karmienia ludzi, którzy normalnie nie mogą jeść przy ustach.
25% mannitolu
Jest to rozwiązanie często stosowane w leczeniu wstrząsów na głowie. Jest czterokrotnie bardziej skoncentrowany niż krew.
7,5% roztwór soli fizjologicznej
Jest to dość skoncentrowane roztwór soli, który jest również wstrzykiwany z niektórymi pacjentami z pewnymi chorobami w żyłach.
Soki komercyjne
Wszystkie soki kupowane w supermarkecie i które nie są naturalne, mają bardzo wysokie stężenia cukru, które czynią je hipertonicznymi.
Bibliografia
- Sweeney J. Zarządzanie hipernatremiią. Pielęgniarstwo. Wrzesień 2010; 40 (9): 63.
- Solanka. Wikipedia. 2021. Pochodzi z.Wikipedia.org/wiki/solanka.
- Woda morska. Wikipedia. 2021. Pochodzi z.Wikipedia.Org/wiki/wodę morską.
- Chavaltamrong B, Pidatcha P, Thavisri U. Elektrolity, cukier, kalorie, osmolarność i pH napojów i wody kokosowej. Południowo -Wschodnia Azji J Trop Med Public Health. Wrzesień 1982; 13 (3): 427-431.
- 5% dekstrozy i 0.45% wstrzyknięcie chlorku sodu, USP. FDA. 2006. Zaczerpnięte z AccessData.FDA.Gov/intratsatfda_docs/etykieta/2006/017607s123lbl.PDF.
- Llorente G, Niño MC. Manitol kontra hipertoniczny roztwór soli fizjologicznej w neuroanestezji. Kolumbijski magazyn anestezjologii. Styczeń-marzec 2015; 43 (1): 29-39.
- Saints MM, E. Leczenie ostrej kwasicy mleczanowej za pomocą dożylnego hipertonicznego chlorku sodu lub roztworów wodorowęglanowych pieprzonych przez wodę śródmiczną. Badania w dziedzinie weterynaryjnych. Luty 2020; 128: 24-34.
- Dini-g. E, Abreu-C. JD, López-M. I. Osmolalność napojów częstego konsumpcji. Badania kliniczne. Grudzień 2004; 45 (4).

