Struktura krzemianu sodu (Na2SIO3), właściwości, zastosowania, ryzyko

- 2185
- 172
- Maksymilian Kępa
On krzemian sodu Jest to związek nieorganiczny utworzony przez dwa jony sodu+ i anion Siio Silicato32-. Mówi się również, że jest tworzona przez cząsteczkę krzemionki Sio2 i jeden z tlenku sodu na2ALBO. Jego wzór chemiczny można wyrazić jako na2Sio3 lub także na2ALBO.Sio2.
Jednak skład krzemianu sodu może się różnić w zależności od relacji SIO2/Na2Lub w wadze lub molach. Nazywa się to również rozpuszczalnym krzemianem lub rozpuszczalnym szkłem. Można go uzyskać w kurzu, dużych kawałkach podobnych do kryształów lub w postaci roztworów.
 Krzemian sodu na2Sio3 solidny. Ondřej Mang [domena publiczna]. Źródło: Wikimedia Commons.
Krzemian sodu na2Sio3 solidny. Ondřej Mang [domena publiczna]. Źródło: Wikimedia Commons. Krzemian sodu ma szerokie zastosowanie w detergentach i mydłach, ponieważ pozwala na zmiękczenie wody, czyniąc czystość bardziej skuteczną. Jest również częścią produktów takich jak krem do golenia.
Jest to surowiec do przygotowania katalizatorów krzemionki Siio2. Jego roztwory są wykorzystywane jako klej w wielu zastosowaniach, od papieru klejowego i kartonu, po szkło, porcelanę, formy oporne, cementowe i ścierne dyski.
Będąc całkowicie niezadowolonym materiałem, służy do produkcji tkanin ognioodpornych, ponieważ jest to opóźnienie przeciwpożarowe, a także jako podszewkę sprzętu ochronnego.
[TOC]
Struktura
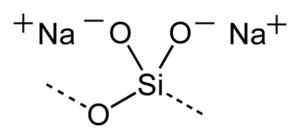 Uproszczona struktura polimerów w roztworach krzemianu sodu. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Uproszczona struktura polimerów w roztworach krzemianu sodu. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Ogólna formuła krzemianów sodu to XSIO2/Na2Lub gdzie x jest rozumem molowym lub wagą.
Rozum molowy oznacza liczbę moli SIO2 podzielone przez liczbę moli na2ALBO. Powód wagi oznacza wagę SIO2 podzielone między wagę NA2ALBO.
Dodając więcej alkaliów (na2O) Współczynnik lub waga molowa zmienia się.
Roztwór krzemianu sodu o niskim stosunku molowym, na przykład 1/1 (1 mol SIO2 i 1 mol Na2O) głównie zawiera monomery SIO44- i dimery s2ALBO52- Oprócz jonów NA+.
Roztwór o wysokim stosunku molowym, takim jak 3,3/1 (3,3 mole SiO2 Dla każdego mol Na2O) Ma wysoki odsetek gatunków polimerowych lub polimerów krzemowych i tlenu.
Może ci służyć: jaki jest błąd?Nomenklatura
-Krzemian sodu
-Bramki sodu
-Rozpuszczalne szkło
-Szkło wodne (angielski Szklanka wody)
-Rozpuszczalny krzemian
Nieruchomości
Stan fizyczny
-Solidne w dużych kawałkach, takich jak niebieskie zielone kryształy
-Bezbarwny do białego proszku
-Bezbarwne roztwory wodne.
Waga molekularna
Formuły Na2Sio3: 122 063 g/mol.
Temperatura topnienia
Na2Sio3: 1089 ° C
Gęstość
To zależy od związku SIO2/Na2ALBO.
Rozpuszczalność
Gdy ma postać dużych zielonkawych szklanych kawałków, jest rozpuszczalny w wodzie, jeśli jest podgrzewany i pod wysokim ciśnieniem. Pył jest nieco bardziej rozpuszczalny, ale w obu przypadkach jego rozpuszczalność zależy od ilości sodu lub na2Lub to, co posiada.
Tym większa zawartość sodu (w postaci Na2O) szybciej rozpuszcza.
Ph
Jego wodne roztwory są silnie alkaliczne.
Właściwości chemiczne
Przygotowuje się komercyjnie w relacjach SIO2/Na2Lub w wadze od 1,5 do 3,3. Wraz ze wzrostem SIO2 W związku zmniejsza się rozpuszczalność w wodzie i zasadowości.
Podczas rozpuszczenia stałego krzemianu w wodzie można tworzyć galaretowate lub bardzo lepkie mieszanki.
Pył krzemianowy sodu może być pyszny, to znaczy, jeśli ma dużą ilość na2Lub ma tendencję do łatwego wchłaniania środowiska środowiska.
Jeśli pH ich roztworów jest zmniejszone przez dodanie kwasu, powstaje żel.
Inne właściwości
To nie jest łatwopalne.
Uzyskanie
Aby uzyskać krzemiany sodu, oparty jest piasek krzemionkowy Sio2 Z węglanem sodu na2WSPÓŁ3 Bezwodny w otwartym piekarniku. Stosunek molowy piasku do węglanu sodu może wahać się w handlu od 0,5 do 3,75.
 Złoża piasku krzemionkowego na obszarze Indii. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Złoża piasku krzemionkowego na obszarze Indii. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Aplikacje
W mydłach i detergentach
Krzem sodu należą do pierwszych związków, które były stosowane w preparatach detergentów.
 Detergenty ogólnie zawierają krzemian sodu w ich składzie. Autor: Karunasanghvi. Źródło: Pixabay.
Detergenty ogólnie zawierają krzemian sodu w ich składzie. Autor: Karunasanghvi. Źródło: Pixabay. Krzemian sodu porywa jony CA wapnia2+ i Magnesio Mg2+, eliminowanie tak zwanej twardości wody, to znaczy, zmiękczanie. Kiedy to robią, powstają nierozpuszczalne osady, więc są używane w małych ilościach.
Może ci służyć: komórki elektrolityczneDziałanie krzemianu sodu umożliwia działanie detergentu bez wspomnianych jonów wpływających na proces czyszczenia.
W katalizatorach i żelach krzemionkowych
Żele krzemionkowe zwykle przygotowują roztwór krzemianu sodu przy pH mniejszym niż 10 lub 11. Czas wymagany do gelfy jest różny.
 Żel krzemionkowy. Aby go przygotować, wymagany jest krzemian sodu. Desicicants [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Żel krzemionkowy. Aby go przygotować, wymagany jest krzemian sodu. Desicicants [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Krzemionkę można przygotować przez zmieszanie krzemianu sodu z silnym kwasem mineralnym. Krzemian sodu jest stosowany w produkujących podstawach do katalizatorów, ponieważ jest źródłem krzemionki sio2.
Jako klej lub klej
Skoncentrowane wodne roztwory krzemianu sodu są stosowane jako kleje i szczeliwa. Mogą utrzymywać temperatury do 1100 ° C.
Główne zastosowania kleju krzemianu sodu znajdują się na papierze klejącym, tekturze falistej lub falistej, pudełkach i kartonie. Również do wklejania lub drewna aglomeratowego lub przylegania metalu do różnych rodzajów materiałów.
 Falista lub falista karton jest wytwarzany za pomocą kleju krzemianowego sodu. Autor: Stux. Źródło: Pixabay.
Falista lub falista karton jest wytwarzany za pomocą kleju krzemianowego sodu. Autor: Stux. Źródło: Pixabay. Służy do wklejania szkła, porcelany, ceramiki, tekstyliów, skóry itp. Aby dołączyć do włókna szklanego, szklanki optyczne i uderzenia szklane.
Pozwala przygotować ogniotrwały cementy do budowy zbiorników, czajników, piekarników i pleśni do wytopu metalu, a także tworzenie zapraw lub cementów do wodoodporności lub kwasu.
Krzemiany sodu mogą reagować z krzemionowymi fluoridami w celu wytworzenia cementów opornych na kwas, z niskim trendem skurczu i rozszerzeniem cieplnym podobnym do rozszerzenia stali.
Są również używane do tworzenia cementów dla dysków ściernych używanych do polowania.
W płynach wiertniczych olejowych
Krzemian sodu jest używany od wielu lat jako chemiczna fuga podczas wiercenia niektórych rodzajów formacji o bardzo wysokiej przepuszczalności, takich jak te, które są utworzone przez piasek.
Wysoka przepuszczalność oznacza, że pozwala płynom łatwo przechodzić.
Może ci służyć: związki organiczneJest dodawany razem ze związkiem, który aktywuje krzemian, tworząc polimer. Ten polimer zapewnia siłę, sztywność i zmniejsza przepuszczalność w glebach ziarnistych.
Będąc mniej przepuszczalną glebą, ciecz nie przechodzi jej swobodnie i w ten sposób unika się utraty płynu podczas fazy wiercenia studni.
 Szyb naftowy. Oil_rig_nt8.JPG: *Pochodna praca: Mudgineer (Talk) Oil_rig_nt.PNG: Tosakaderivative Prace: Malyszkz [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons.
Szyb naftowy. Oil_rig_nt8.JPG: *Pochodna praca: Mudgineer (Talk) Oil_rig_nt.PNG: Tosakaderivative Prace: Malyszkz [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons. W różnych aplikacjach
Krzemian sodu ma również różne zastosowania. Niektóre są wymienione poniżej.
-Na przykład w codziennych produktach opieki jest składnik kremów do golenia.
-W obróbce wody.
-W wybielaniu tekstyliów, takich jak wełna.
-W wybielaniu pulpy papierowej. Na przykład, aby wybielacz mielony drewno, mieszanina zawiera nadtlenek wodoru i krzemian sodu wśród innych składników. Krzemian sodu służy do porwania jonów metali, które mają tendencję do przyspieszenia rozkładu nadtlenku.
-Do produkcji tkanin ognioodpornych. Jako opóźnienie przeciwpożarowe i jako powlekanie sprzętu ochronnego.
-W pigmentach krzemionkowych.
-Wykryć ziarna kukurydziane zarażone przez owady. Zastosuje się mieszaninę krzemianu sodu i wody, w której zarażone ziarna szybko unoszą się na powierzchni.
-W elektrodkupie cynku.
-Do czyszczenia metali.
-W flotacji mineralnej jest stosowany jako szlam i szlam.
-Aby zaimpregnować drewno.
Ryzyko
Krzemian sodu ze względu na wysoką zawartość alkalii to silna drażniona skóra, oczy i błony śluzowe. Jeśli zostanie spożywany, może być toksyczny i podrażniać błony śluzowe podobne do roztworów sody kaustycznej.
Musi być przechowywany osobno od silnych kwasów, metali i halogenów, takich jak fluor, z którymi reaguje gwałtownie.
Bibliografia
- Ebnejjad, s. (2015). Charakterystyka materiałów klejowych. Rozpuszczalne krzemiany (potas i krzemian sodu). W podręczniku klejów i przygotowania powierzchni. Odzyskane z naukowym.com.
- Fink, J.K. (2012). Dodatki do utraty płynów. Metasilizowanie sodu. W przewodniku inżyniera ropy naftowej po chemikaliach i płynach naftowych (wydanie drugie). Odzyskane z naukowym.com.
- LUB.S. National Library of Medicine. (2019). Krzemian sodu. National Center for Biotechnology Information. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer. (1984). Encyclopedia of Chemical Technology, wydanie 3., John Wiley i synowie.
- Maeda, k. i in. (2007). Od zeolitów po porowate materiały MOF - 40th Rocznica Międzynarodowej Konferencji Zeolite. W badaniach naukowych i katalizy. Odzyskane z naukowym.com.
- Chopade, s.P. I Nagarajan, K. (2000). Preparaty detergentu: jon wymiany. W Encyklopedii Separation Science. Odzyskane z naukowym.com.
- Garcia-Lodeiro, i. i in. (2015). Kluczowe wgląd w konstrukcję mieszanki wiążących opartych na cementach aktywowanych alkalia. Wpływ krzemianów: stopień rozpuszczalnej polimeryzacji krzemianu. W podręczniku cementu aktywowanego alkalicznego, zapraw i betonów. Odzyskane z naukowym.com.
- « Historia światła, natura, zachowanie, propagacja
- Struktura jodku sodu (NAI), właściwości, zastosowania, ryzyko »

