SGLT (białka transportowe sodu)
- 1556
- 381
- Bertrand Zawadzki
Białka transportowe sodu-glukozy (Sglt) Są odpowiedzialni za przeprowadzanie aktywnego transportu glukozy w komórkach ssaków przeciwko gradientowi stężenia. Energia wymagana do możliwego transportu jest pozyskiwana z Cotransport sodu w tym samym kierunku (Simport).
Jego lokalizacja jest ograniczona do błony komórek, które tworzą tkanki nabłonkowe odpowiedzialne za wchłanianie i wchłanianie składników odżywczych (cienkie jelito i proksymalna wyprofilowana kanalika nerki).
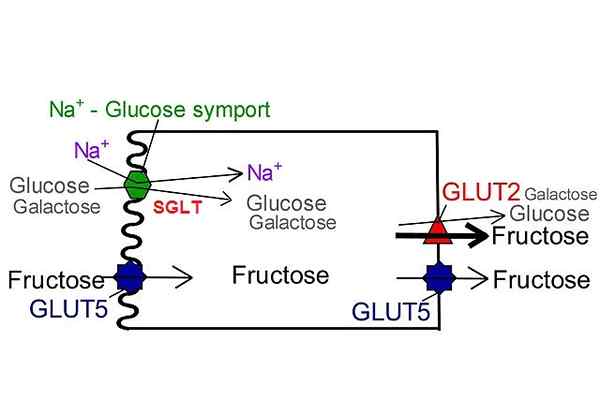
 SGLT Transportery glukozy w przeciwieństwie do Glut. Autor: NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], zmodyfikowany z wikimedia Commons.
SGLT Transportery glukozy w przeciwieństwie do Glut. Autor: NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], zmodyfikowany z wikimedia Commons. Do tej pory opisano tylko sześć izoform należących do tej rodziny transporterów: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 i SGLT-6. We wszystkich z nich prąd elektrochemiczny generowany przez transport jonu sodu zapewnia energię i indukuje zmianę konformacyjną w strukturze niezbędnego białka do translokacji metabolitu po drugiej stronie błony.
Jednak wszystkie te izoformy różnią się od siebie, przedstawiając różnice w:
- Stopień powinowactwa, jakie mają do glukozy,
- Zdolność do przeprowadzania transportu glukozy, galaktozy i aminokwasów,
- Stopień, w jakim są zahamowane przez Florizinę i
- Lokalizacja tkanek.
[TOC]
Mechanizmy molekularne transportu glukozy
Glukoza jest monosacharydem sześciu atomów węgla, który jest wykorzystywany przez większość istniejących typów komórek w celu uzyskania energii poprzez metaboliczne szlaki utleniania.
Biorąc pod uwagę jego duży rozmiar i zasadniczo natura hydrofilowa, nie jest w stanie przekroczyć błon komórkowych przez wolną dyfuzję. Dlatego jego mobilizacja cytosolu zależy od obecności białek transportowych w tych błonach.
Dotychczasowe badane transportery glukozy wykonują transport tego metabolitu za pomocą biernych lub aktywnych mechanizmów transportu. Transport pasywny różni się od aktywnego transportu, w którym nie wymaga realizacji zasilania energii, ponieważ występuje na korzyść gradientu stężenia.
Może ci służyć: naskórka cebuliBiałka biorące udział w pasywnym transporcie glukozy należą do rodziny rozpowszechnionych przewoźników przewoźników, zwanych zatem akronimem w języku angielskim terminu „transportery glukozy”. Podczas gdy ci, którzy przeprowadzają aktywny transport, zostały nazywane SGLT przez „białka transportowe sodu”.
Te ostatnie uzyskują niezbędną energię swobodną do przeprowadzenia transportu glukozy w stosunku do jego gradientu stężenia jonu sodu Cotransport. Zidentyfikowano co najmniej 6 izoform SGR, a jego lokalizacja wydaje się ograniczać się do błon komórek nabłonkowych.
Charakterystyka SGLT
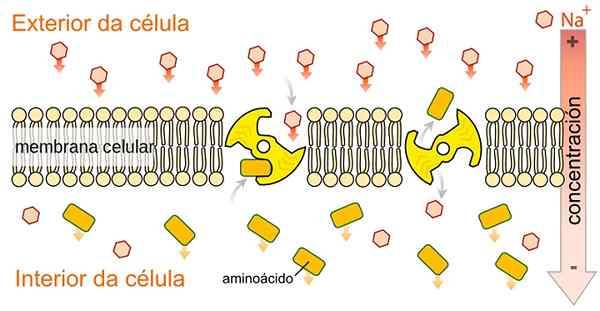 Trenery SLGT Simport nie są specyficzne dla glukozy, są w stanie transportować inną różnorodność metabolitów, takich jak aminokwasy, galaktoza i inne metabolity, ponieważ wykorzystują energię uwalnianą przez Cotransport jonów sodu na korzyść gradientu stężenia. Przez sprephats [CC0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0), z Wikimedia Commons.
Trenery SLGT Simport nie są specyficzne dla glukozy, są w stanie transportować inną różnorodność metabolitów, takich jak aminokwasy, galaktoza i inne metabolity, ponieważ wykorzystują energię uwalnianą przez Cotransport jonów sodu na korzyść gradientu stężenia. Przez sprephats [CC0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0), z Wikimedia Commons. Jak wskazuje jego nazwa, białka transportu sodu i glukozy wykonują typ sodu sodu i glukozy lub cytosolu typu galaktozy i galaktozy w cytosolu komórkowym.
Transport sodu na korzyść gradientu stężenia jest odpowiedzialny za generowanie niezbędnej energii swobodnej w celu zmobilizowania glukozy ze strefy niskiego stężenia do wysokiego stężenia.
Te transportery są częścią grupy białka antytransportowego i współczucia sodu i wodoru, których geny nie są powiązane z filogenetycznie.
Jego lokalizacja jest ograniczona do błony luminalnej komórek nabłonkowych tkanek zaangażowanych w absorpcję składników odżywczych, takich jak cienki jelita i proksymalna wyprofilowana kanalika.
Może ci służyć: Coxiella purnetiiTypy SGLT
Do tej pory zidentyfikowano sześć transporterów SGLT (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 i SGLT-6). Wszystkie wykazują różnice w preferencji transportu glukozy lub galaktozy, powinowactwo, które przedstawiają dla tych cukrów i sodu, a także przez fakt, że można zahamować przez Florizinę.
SGLT1 ma zdolność do transportu galaktozy oprócz glukozy z bardzo podobną kinetyką, podczas gdy SGLT2 transportuje tylko glukozę.
Struktura GSLT
Długość sekwencji peptydowej białek SGLT wynosi od 596 do 681 odpadów aminokwasowych. Tymczasem odsetki homologii między sekwencjami wahają się między 50 a 84 % w stosunku do SGLT-1, co jest największym stopniem rozbieżności w sekwencjach odpowiadających terminali aminowej domeny pozakomórkowej i końcowej karboksylu.
Ogólna struktura pokrywa się z strukturą białka integralnego multipaso, to znaczy wielokrotnie przekracza błonę przez domeny transbłonowe bogate w hydrofobowe aminokwasy.
Te domeny transbłonowe mają w sumie 14, a każda z nich ma wtórną strukturę α-helix. Segmenty 1, 2, 5, 7 i 9 są przestrzennie zorganizowane w pozycji centralnej, co daje powstawanie porów hydrofilowych.
Przez hydrofilowe pory przemijają glukozę, a także którykolwiek z innych metabolitów, dla których transporter może mieć powinowactwo. Pozostałe fragmenty spiralne są zorganizowane równolegle, aby nadać większą stabilność strukturalną do kanału.
Funkcje SGLT
Członkowie rodziny SGLT nie wykazują unikalnej specyficzności dla glukozy. Przeciwnie, są w stanie aktywnie mobilizować się przez błonę komórek kanalików nerkowych i nabłonka jelitowego szeroką gamę metabolitów, takich jak aminokwasy, jony, glukoza i osmolity.
Funkcją tego typu transporterów, które były szersze badane, jest reabsorpcja glukozy obecnej w moczu.
Może ci służyć: embriologia porównawcza: co to jest, jakie studia, historia, teorieTen proces reabsorpcji obejmuje mobilizację węglowodanów z kanalików nerkowych przez komórki nabłonka rurowe do światła naczyń włosowatych. Będąc izoformą o dużej pojemności i powinowactwa do glukozy SGLT-2, która jest głównym podatnikiem.
Funkcja absorpcji glukozy w przewodzie pokarmowym przypisuje się SGLT-1, przenośnik, który pomimo niskiej pojemności ma wysokie powinowactwo do glukozy.
Trzeci członek tej rodziny, SGLT3, jest wyrażany w błonach szkieletowych komórek mięśni i układu nerwowego, gdzie wydaje się nie działać jako transporter glukozy, ale jako czujnik stężenia tego cukru w pożywce zewnątrzkomórkowej.
Funkcje izoform SGLT4, SGLT5 i SGLT6 nie były do tej pory pewne.
Bibliografia
- Abramson J, Wright EM. Struktura i funkcja symporterów Na z odwróconymi powtórzeniami. Curr Ace struct biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Badania mechanizmu wchłaniania jelita cukrów. VII. Transport fenylgllikozydu i jego możliwy związek z hamowaniem foryziny transportu Actice Sugs przez mały instest. Biochim Biophys Act. 1964; 93: 116-135.
- Charron FM, Blanchard MG, LaPointe JY. Hipertoniczność wewnątrzkomórkowa jest odpowiedzialna za strumień wody związany z Cotransport Na_/glikozę. Biophys J. 2006; 90: 3546-3554.
- Chen Xz, Coady MJ, LaPointe JY. Szybkie zaciski napięcia ZWYCJE DO NOWEGO Składnika prądów w stanie Perady z Cotransportera Na_-glukozy. Biophys J. 1996; 71: 2544-2552.
- Dyer J, Wood Is, Palejwala A, Ellis A, Shirazi-Beechey SP. Ekspresja transporterów monosacharydów w jelicie ludzi cukrzycowych. Am J Physiol Gastrointest Wątroba Physiol. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. Domniemana lokalizacja tkanek i funkcja członka rodziny SLC5 SGLT3. Exp Physiol. 2017; 102 (1): 5-13.
- Turk e, wright em. Motywy topologii błony w rodzinie SGG Cotransporter. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, Him J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Charakterystyka molekularna Vibrio parahaemolyticus VSGLT: Model do cotransporterów cukru sprzężonego z sodą. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Analiza i przewidywanie miejsc wiązania węglowodanów. Białko ENG. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama BA. Biologia ludzkich transporterów glukozy sodu. Physiol Rev. 2011; 91 (2): 733-794.
- « Charakterystyka magnetosfery Ziemi, struktura, gazy
- Elementy magnetyczne i pola magnetyczna Ziemi »

