Charakterystyka, typy i wybrane funkcje
- 4641
- 119
- Paweł Malinowski
SelectInas Są rodziną glikoprotein utworzonych przez łańcuchy polipeptydowe, które rozpoznają specyficzne konformacje cukrów (węglowodany), znajdujące się na powierzchni innych komórek i wiążą się z nimi. Z tego powodu są również nazywane cząsteczkami adhezji.
Te receptory adhezji są znane z zachowanej struktury. Prezentują trzy domeny i trzy różne glikoproteiny. Można je wyrażać jako cząsteczki powierzchniowe, oprócz przechowywania lub funkcjonowania jako rozpuszczalne cząsteczki.
 Struktura molekularna selektyny p. Zrobione i zredagowane z: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Struktura molekularna selektyny p. Zrobione i zredagowane z: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. W przeciwieństwie do innych cząsteczek adhezyjnych, selektyny działają tylko w interakcjach białych krwinek z śródbłonkiem naczyniowym.
[TOC]
Charakterystyka
Wszystkie wybrane są białka zawierające oligosacharydy łańcuchowe, połączone kowalencyjnymi wiązaniami z bocznymi łańcuchami aminokwasowymi (glikoproteiny). Są to cząsteczki transbłonowe, co oznacza, że przekraczają biwagy lipidowy.
Mają charakterystykę bardzo podobną do białek CLEC lub Lectinas typu C. Ponieważ, jako lektyny typu C, selektyny wymagają jonów wapnia do wykonania połączenia.
Pochodzenie słowa „selekcja” odnosi się do faktu, że białka te selektywnie wyrażają w komórkach układu naczyniowego, a także zawierają domenę lektyny.
Niektórzy autorzy obejmują wybrane (glikoproteiny) w lektinach, ponieważ są to cząsteczki wiążące się z cukrami. Jednak inni autorzy różnicują ich w koncepcji, że Lektyny rozpoznają tylko węglowodany i dołączają do nich, podczas gdy Selectin nie tylko rozpoznają i łączą cukry, ale są również tworzone przez węglowodany.
Regulacja selekcji występuje na poziomie transkrypcji, poprzez przetwarzanie proteolityczne, przez klasyfikację komórkową i poprzez regulowane wyrażenia transferaz glikozilowych.
Selectiny mają krótką domenę wewnątrzkomórkową. Mają jednak trzy domeny pozakomórkowe, domenę typu naskórkowego czynnika wzrostu, domenę lektyny typu C i jednostek powtórzeń, podobnie jak białka regulacyjne dopełniacza.
Może ci służyć: komórki Hele: historia, cechy, cykl komórkowy i zastosowaniaChłopaki
Rodzina Selectin składa się z trzech różnych rodzajów glikoprotein. Każdy z nich jest identyfikowany z literą, która oznacza miejsce, w którym zostały po raz pierwszy zidentyfikowane. Następnie zobaczymy każdego z nich.
L-selektyna
Jest również znany jako Sell, CD62L, LAM1, LEU8, LNHR, LSEL lub TQ1. Występuje w leukocytach, stąd „L” selektyny. Jest to składnik powierzchni komórki. Trzy domeny to: odpowiednik z Lectinas, naskórkowy czynnik wzrostu i dwie jednostki powtórzeń.
Przedstawia kilka ligandów, to znaczy na ogół małych cząsteczek, które tworzą kompleks z biomolekułą, w tym przypadku białko. Znane ligandy dla selektyny L to następujące.
Glycam1
Jest to cząsteczka -1 adhezji komórkowej zależnej od glikozylacji, jest ligandem proteoglikanu, który jest wyrażany w zapaleniach żylnych po kapilarii i pozwala limfocytach przejść do krwioobiegu w kierunku tkanek limfatycznych.
CD34
Jest to fosfographoproteina, wykryta w kilku grupach ssaków, takich jak człowiek, szczury i myszy,. Po raz pierwszy opisano w hematopoetycznych komórkach macierzystych. Znajdują się w różnych komórkach, ale jest to prawie wyłącznie związane z hematopoetycznych.
MadCam-1
Znana jako cząsteczka adhezji komórek lub komórek w kierunku błony śluzowej naczyniowej (w języku angielskim cząsteczka adhezji komórek naczyniowych 1). Jest to zewnątrzkomórkowe białko śródbłonka, które jest odpowiedzialne za określenie, w którym tkanki wchodzą limfocyty, oprócz przenoszenia cukrów, tak aby były rozpoznawane przez l-selektynę L-selektynę.
PSGL-1
Znany wśród innych synonimów jako SELPLG lub CD162, jest to glikoproteina występująca w komórkach śródbłonka i leukocytach. Możesz dołączyć do pozostałych dwóch rodzajów selektyn. Wydaje się jednak, że stanowi lepsze powinowactwo do selektyny p.
Może ci służyć: komórki grzybowe: cechy, organelle i funkcjeSelektyna p
Selektyna P jest znana między innymi pod innymi nazwami, takimi jak SELP, CD62, CD62P, GMP140, GRMP lub LECAM3. Znajduje się na powierzchni komórek śródbłonka, które obejmują wewnętrzne marginesy naczyń krwionośnych i płytek krwi.
Selektynę P po raz pierwszy zidentyfikowano w płytkach krwi. Dlatego nazwa białka przenosi początkowe „P”.
Struktura selektyny p składa się z domeny bardzo podobnej do lektyny typu C na końcu N EGF; Oznacza to, że konserwowana domena białka o wartości około 30 do 40 odpadów aminokwasowych, z dwupatenowym liściem β, a następnie pętli do krótkoterminowego bikatenowego liścia β-końcowego.
Przedstawia trzecie miejsce w przypadku uzupełniającego białka do uzupełnienia, takiego jak domena Cub, która charakteryzuje się jako domena białka zachowana ewolucyjnie i przedstawia około 110 odpadów aminokwasowych.
Ligand o większym powinowactwie selektyny p to PSGL-1, jak opisano wcześniej w ligandach-selektyny L. Z drugiej strony białko to może również tworzyć kompleksy z innymi cząsteczkami, takimi jak siarczanowy polisacharyd zwany fucoidanem i siarczanem heparánowym.
Selektyna E
To białko Selectin jest również znane pod następującymi nazwami: Sele, CD62E, ELAM, ELAM1, ESEL, LECAM2 i inne. Jest wyrażany wyłącznie w komórkach śródbłonka, które są aktywowane przez małe białka, które nie są w stanie przekroczyć dwuwarstw lipidowej komórki, zwane cytokinami.
Struktura tego białka składa się z 3 domen (takich jak reszta selekcji): domena podobna do EGF, 6 jednostek modułów białkowych kontrolnych (zwanych także domenami sushi) powtórnego SCR i domeny transbłonowej.
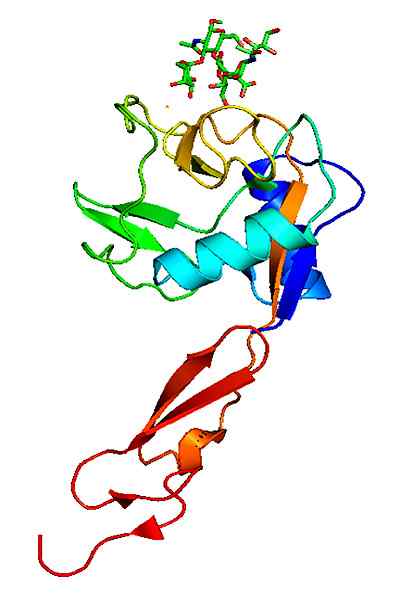
Może ci służyć: megakarioocyty: charakterystyka, struktura, formacja, dojrzewanie Reprezentacja struktury molekularnej białka selektyny E, którego domino jest EGF. Zrobione i zredagowane z: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna].
Reprezentacja struktury molekularnej białka selektyny E, którego domino jest EGF. Zrobione i zredagowane z: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna]. Ligand, który tworzy kompleksy z selektywnością elektroniczną, są dość zróżnicowane, ale te, które się wyróżniają, są następującymi.
Sialyl-Lewis a
Nazywany także SLE a o CA19-9. Jest to tetrasacharyd w surowicach pacjentów z rakiem. Wiadomo, że uczestniczy w procesie rozpoznawania komórek. Jest wyrażany konstytutywnie w granulocytach, monocytach i limfocytach t.
Sialyl-Lewis x
Jest to również tetratasacharyd taki jak sialyl-lewis a i ma podobne funkcje. Jest wyrażany w granulocytach i monocytach i kontroluje niepożądane wyjście lub wyciek tych komórek podczas zapalenia.
PSGL-1
Chociaż jest to najwyraźniej bardziej wydajne w selektynie P, niektórzy autorzy uważają, że forma pochodząca z neutrofili ludzkiego jest również dość wydajna w selektynie e-selektyny. W rzeczywistości uważają, że ogólnie ligand ten ma fundamentalne znaczenie dla trzech rodzajów wybranych.
Funkcjonować
Główną funkcją Selectins jest bycie częścią procesu tworzenia białych krwinek (limfocyty). Uczestniczą również w odpowiedzi immunologicznej, w przewlekłych i ostrych stanach zapalnych w różnych narządach ciała, takich jak nerki, serce i skóra. Działają nawet w procesach zapalnych przerzutów rakotwórczych.
Bibliografia
- Selectin. Źródło: w:.Wikipedia.org.
- L-selektyna. Źródło: w:.Wikipedia.org.
- CA19-9. Źródło: w:.Wikipedia.org.
- Selektyna E. Źródło: w:.Wikipedia.org.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, L.DO. Smith, m.J. Wargo, k.DO. Interliggi, c.M. Lloyd, zm.F. Tees, ur. Walcheck, m.B. Lawrence, zm.J. Goetz (2005). PSGL-1 wyśmiewany z ludzkich neutrofili jest ligandem o wysokiej wydajności dla edotheli-ekspresji e-selektyny e-selektyny pod przepływem. American Journal of Physiology. Fizjologia komórkowa.
- K. Prawo (2001). Funkcje selekcji. Wyniki i problemy z różnicowaniem komórek.
- SelectInas. Odzyskane z: Wellpath.Uniovi.Jest.
- J.H. Pérez i C.J. Montoya. Cząsteczki adhezji. Źródło: enolombia.com.
- DO.C. Sanguineti i J.M Rodríguez-Tafur (1999). Przyczepność i cząsteczki skóry. Dermatologia peruwiańska.
- T.F. Tedder, d.DO. Steeber, a. Chen, str. Engel (1995). Selektyny: cząsteczki adhezji naczyniowej. FASEB Journal.

