Sole diazonium

- 4105
- 245
- Paweł Malinowski
Wyjaśniamy, jakie są sole diazonium, w jaki sposób tworzone są ich właściwości i zastosowania
Co to są sole diazonium?
Sole diazonium Są to związki organiczne, w których istnieją interakcje jonowe między grupą azo (-n2+) I anion x- (Cl-, F-, Ch3Gruchać-, itp.). Jego ogólna formuła chemiczna to RN2+X-, i w tym łańcuchu bocznym R może być dobrze alifatyczną lub grupą arylową; to znaczy aromatyczny pierścień.
Na niższym obrazie reprezentowana jest struktura jonu arenodiazoniowego. Niebieskie kule odpowiadają grupie AZO, podczas gdy czarno -białe tworzą aromatyczny pierścień grupy fenylowej. AZ+≡N).

Istnieją jednak struktury rezonansowe, które delokalizują to dodatnie obciążenie, na przykład w atomie sąsiedniego azotu: -n = n+. Pochodzi to, gdy kilka elektronów tworzących link jest skierowany do atomu azotu po lewej stronie.
Podobnie, to dodatnie obciążenie jest w stanie democjacja przez układ PI pierścienia aromatycznego. W konsekwencji aromatyczne sole diazonium są bardziej stabilne niż alifatyczne, ponieważ dodatnie obciążenie nie może zdegradować wzdłuż łańcucha węglowego (CH3, Ch2Ch3, itp.).
Szkolenie
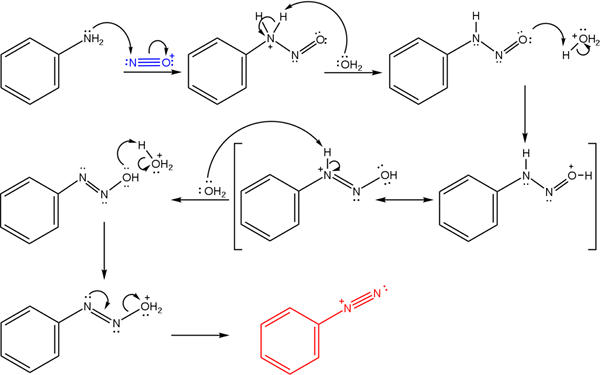
Sole te pochodzą z reakcji pierwotnej aminy z kwasową mieszaniną azotynu sodu (nano2).
Wtórne aminy (r2NH) i trzeciorzęd3N) Inne produkty azotowe, takie jak N-nitrozoamina (które są olejkami żółtawymi), sole aminowe (r3Hn+X-) i n-nitrozoniowe związki.
Najwyższy obraz ilustruje mechanizm, za pomocą którego rządzi się tworzenie soli diazonium, lub znany również jako reakcja diazotyzacyjna.
Może ci służyć: Chrome (Cr)Reakcja zaczyna się od fenyloaminy (AR-NH2), który wykonuje atak nukleofilowy na atom kationowy NINROSONIUM (nie+). Ten kation jest wytwarzany przez mieszaninę nano2/Hx, gdzie x jest zwykle cl; to znaczy HCL.
Powstawanie kationu nitrozonium uwalnia wodę na środku, co porywa pozytywnie obciążony protonem azotu.
Następnie ta sama cząsteczka wody (lub inne gatunki kwas3ALBO+) dają proton do tlenu, demokrując dodatnie obciążenie w mniej elektroonegatywnym atomie azotu).
Teraz woda ponownie nie zabezpieczona do azotu, a następnie wytwarzając cząsteczkę diazohydroksydową (przede wszystkim sekwencji).
Ponieważ pożywka jest kwaśna, diazohydroksyd cierpi na odwodnienie grupy OH; Aby przeciwdziałać elektronicznej wakatu, bezpłatny moment obrotowy potrójnego ogniwa grupy AZO.
W ten sposób na końcu mechanizmu chlorek Bencenodiazonium pozostaje w roztworze (C6H5N2+Cl-).
Nieruchomości
Zasadniczo sole diazonium są bezbarwne i krystaliczne, rozpuszczalne i stabilne w niskich temperaturach (mniej niż 5 ° C).
Niektóre z tych soli są tak wrażliwe na uderzenie mechaniczne, że każda fizyczna manipulacja mogłaby je zdetonować. Wreszcie reagują z wodą, tworząc fenole.
Reakcje przemieszczenia
Sole diazonium to potencjalny azot molekularny, którego tworzenie jest wspólnym mianownikiem reakcji przemieszczenia. W nich gatunek X wypiera niestabilną grupę azową, uciekając jako n2(G).
Reakcja Sandmeyera
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Reakcja Gattermana
RNA2+ + Cux => arx + n2 + Cu+
W przeciwieństwie do reakcji Sandmeyera, reakcja Gattermana ma metalową miedź zamiast jego halogenku; Oznacza to, że Cux jest generowany In situ.
Reakcja Schiemann
[RNA2+] BF4- => ARF + BF3 + N2
Może ci służyć: ketony: typy, właściwości, nomenklatura, zastosowania, przykładyReakcja Schiemanna charakteryzuje się termicznym rozkładem fluoroboratu benzezonium.
Reakcja Gomberga Bachmanna
[RNA2+] Cl- + C6H6 => AR - C6H5 + N2 + HCl
Inne przemieszczenia
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3PO2 + H2O => c6H6 + N2 + H3PO3 + HCl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Pieczęć2 => Arno2 + N2 + Cu+
Reakcje redoks
Sole diazoniowe można zmniejszyć do arilhydrazinów, stosując mieszaninę CNCL2/HCL:
RNA2+ => Arnhnh2
Można je również sprowadzić do arilamin w silniejszych redukcjach z Zn/HCl:
RNA2+ => Rnah2 + NH4Cl
Rozkład fotochemiczny
[RNA2+] X- => Arx + n2
Sole diazonium są wrażliwe na rozkładu przez częstość występowania promieniowania ultrafioletowego lub przy bardzo bliskich długościach fali.
Reakcje sprzęgania azowe
RNA2+ + Ar'H → RNA2Ar ' + h+
Te reakcje są prawdopodobnie najbardziej przydatne i wszechstronne z soli diazoniowych. Sole te są słabymi elektrofilami (pierścień przenosi dodatnie obciążenie grupy AZO). Aby reagować ze związkami aromatycznymi, muszą być naładowane ujemnie, powodując w ten sposób związki Azos.
Reakcja przechodzi z wydajną wydajnością między pH 5 a 7. W kwasowym pH sprzężenie jest niższe, ponieważ protony grupy azowej, co uniemożliwia atak negatywnego pierścienia.
Ponadto w podstawowym pH (ponad 10) sól diazoniowa reaguje z OH- Wytwarzać diazohydroksyd, który jest stosunkowo obojętny.
Struktury tego typu związków organicznych mają bardzo stabilny sprzężony układ PI, którego elektrony absorbują i emitują promieniowanie w widmie widzialnym.
W konsekwencji związki azowe charakteryzują się kolorami. Z powodu tej właściwości nazywano je również kolorami azoicki.
Może ci służyć: molowość: koncentracja, jednostki, obliczenia, ćwiczenia
Najwyższy obraz ilustruje koncepcję sprzężenia z pomarańczą metylu jako przykład. W środku jego struktury można zaobserwować grupę azową służącą jako złącze dwóch pierścieni aromatycznych.
Który z dwóch pierścieni był elektrezą na początku sprzężenia? Ten po prawej, ponieważ grupa sulfonianowa (-so3) Wyłącz gęstość pierścienia elektronicznego, dzięki czemu jest jeszcze bardziej elektrofilowy.
Aplikacje

Jednym z jego najbardziej komercyjnych zastosowań jest produkcja barwników i pigmentów, obejmująca również przemysł tekstylny w stopniach tkanin. Te azoickie związki są zakotwiczone w określonych miejscach molekularnych polimeru, umierając z kolorów.
Ze względu na rozkład fotolityczny jest on (mniej niż wcześniej) używany w reprodukcji dokumentów. Jak? Papierowe obszary pokryte specjalnym plastikiem są usuwane, a następnie nakładane jest podstawowe roztwór fenolu, barwę litery lub projektowanie niebieskiego.
W syntezie organicznej są one stosowane jako punkty początkowe dla wielu aromatycznych pochodnych.
Wreszcie, mają zastosowania w dziedzinie inteligentnych materiałów. W nich połączona jest powierzchnia (na przykład złoto), co pozwala jej udzielić reakcji chemicznej na zewnętrzne bodźce fizyczne.

