Rubidio Historia, właściwości, struktura, uzyskiwanie, użycie

- 1497
- 44
- Pani Gilbert Stolarczyk
On rubid Jest to element metaliczny, który należy do grupy 1 tabeli okresowej: element metali alkalicznych, reprezentowany przez symbol chemiczny RB. Jego imię brzmi jak rubí i dzieje się tak, ponieważ kiedy odkryto jego spektrum emisji, wykazywał intensywne czerwone linie.
Jest to jeden z najbardziej reaktywnych metali. Jest to pierwszy z metali alkalicznych, który pomimo tego, że jest mało gęsty, zatopi się w wodzie. Reaguje również z nią bardziej wybuchowo w porównaniu do litu, sodu i potasu. Nastąpiły eksperymenty, w których ampułki są przechowywane (niższy obraz) do upadku i eksplodowania w wannach.
 Ampula z gramem Rubidium przechowywanego w obojętnej atmosferze. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Ampula z gramem Rubidium przechowywanego w obojętnej atmosferze. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Rubidio wyróżnia się jako metal droższy niż to samo złoto; Nie tyle ze względu na jego brak, ale ze względu na szeroki rozkład mineralogiczny w skorupie Ziemi i trudności, które powstają podczas izolowania go z potasu i zaprzestania związków.
Pokazuje wyraźną tendencję do kojarzenia się z potasem w minerałach, uważając zanieczyszczenia. Nie tylko w materii geochemicznej tworzy duet z potasem, ale także w dziedzinie biochemii.
Organizm „myli” jony K+ Dla tych z RB+; Jednak Rubidio nie jest do tej pory niezbędnym elementem, ponieważ nie wiadomo, jaką rolę odgrywa w metabolizmie. Mimo to suplementy Rubidium zostały wykorzystane do złagodzenia niektórych schorzeń, takich jak depresja i padaczka. Z drugiej strony oba jony strzelają fioletowego płomienia w upale zapalniczki.
Ze względu na wysokie koszty jego zastosowania nie są zbyt duże w syntezie katalizatorów lub materiałów, ale jako komponent dla różnych urządzeń z fizycznymi podstawami teoretycznymi. Jednym z nich jest zegar atomowy, ogniwa słoneczne i magnetometry. Dlatego czasami Rubidium jest traktowane jako niedoceniany lub mało badany metal.
[TOC]
Historia
Rubidio został odkryty w 1861 roku przez niemieckich chemików Robert Bunsen i Gustav Kirchhoff, używając spektroskopii. Aby to zrobić, użyli zapalniczki Bunsena i spektroskopu, wynalezione dwa lata wcześniej, oprócz technik analitycznych opadów. Jego przedmiotem studiów był minerał lepidolite, którego pokazuje zbiór saksonii w Niemczech.
Zaczęli od 150 kg minerału lepidolitowego, które leczyli kwasem chloroplatynowym, H, H2PTCL6, Aby wytrącić heksakloroplatyn potasu, k2PTCL6. Jednak kiedy studiowali swoje spektrum, spaląc je w zapalniczce, zdali sobie sprawę, że wystawili linie emisji, które do tego czasu nie pokryły się z żadnym innym elementem.
Widmo emisji tego nowego elementu charakteryzuje się posiadaniem dwóch linii zdefiniowanych w dobrze zdefiniowanych studniach w kolorze czerwonym. Dlatego został ochrzczony nazwą „Rubidus”, co oznacza „ciemnoczerwony”. Następnie Bunsen i Kirchhoff udało się oddzielić RB2PTCL6 k2PTCL6 przez frakcjonowaną krystalizację; Aby w końcu zmniejszyć go do soli chlorkowej za pomocą wodoru.
Zidentyfikowane i wyizolowane sól nowego pierwiastka Rubidio, niemieccy chemicy musieli jedynie zmniejszyć go do stanu metalicznego. Aby to osiągnąć, próbowali na dwa sposoby: zastosuj elektrolizę do chlorku Rubidium lub podgrzewaj łatwą sól do zmniejszenia, takiego jak Tartrato. W ten sposób narodził się metaliczny Rubidio.
Fizyczne i chemiczne właściwości
Wygląd
Srebrny szary metal. Jest tak miękki, że wygląda jak masło. Zwykle jest pakowany w szklanych ampułkach, w których dominuje obojętna atmosfera, która chroni ją przed reakcją z powietrzem.
Liczba atomowa (z)
37
Masa cząsteczkowa
85 4678 g/mol
Temperatura topnienia
39 ° C
Punkt wrzenia
688 ° C
Gęstość
W temperaturze pokojowej: 1532 g/cm3
W punkcie topnienia: 1,46 g/cm3
Gęstość Rubidium jest lepsza od godności wody, więc zatopi się podczas gwałtownej reakcji.
Fusion Heat
2,19 kJ/mol
Ciepło parowe
69 kJ/mol
Elektronialiczność
0,82 w skali Pauling
Powinowactwo elektroniczne
46,9 kJ/mol
Energie jonizacyjne
-Po pierwsze: 403 kJ/mol (RB+ gazowy)
-Drugi: 2632.1 kJ/mol (RB2+ gazowy)
-Po trzecie: 3859,4 kJ/mol (RB3+ gazowy)
Radio atomowe
248 PM (empiryczne)
Przewodność cieplna
58,2 W/(M · K)
Rezystancja
128 nω · m w 20 ° C
Twardość mohs
0,3. Dlatego nawet talk jest trudniejszy niż metaliczny Rubidium.
Reaktywność
 Próba płomienia dla Rubidium. Kiedy reaguje, pożegna się z fioletowym płomieniem. Źródło: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Próba płomienia dla Rubidium. Kiedy reaguje, pożegna się z fioletowym płomieniem. Źródło: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Rubidio jest jednym z najbardziej reaktywnych metali alkalicznych, po Cesio i Francio. Ledwo jest narażony na powietrze, zaczyna palić. Jeśli jest podgrzewany, emituje także fioletowy płomień (obraz doskonały), który jest pozytywnym testem dla jonów RB+.
Może ci służyć: Ididio 192Reaguje z tlenem, tworząc mieszaninę nadtlenków (RB2ALBO2) i nadtlenki (RBO2). Chociaż nie reaguje z kwasami i zasadami, narusza je z wodą, wytwarzając wodorotlenek gazu rubidium i wodoru:
RB (S) + H2Lub (l) => rboh (ac) + h2(G)
Reaguje z wodorem, tworząc odpowiedni wodork:
RB (S) + H2(g) => 2RBH (s)
A także z halogenami i siarką wybuchowo:
2RB (S) + CL2(g) => rbcl (s)
2RB (s) + s (l) => rb2H.H)
Chociaż Rubidium nie jest uważane za element toksyczny, jest potencjalnie niebezpieczny i reprezentuje ryzyko pożarowe, jeśli chodzi o kontakt z wodą i tlenem.
Struktura elektroniczna i konfiguracja
Atomy Rubidio są ułożone w taki sposób, że ustanawiają kryształ struktury sześciennej wyśrodkowany w ciele (BCC). Ta struktura jest charakterystyczna dla metali alkalicznych, które są lekkie i mają tendencję do unoszenia się nad wodą; Z wyjątkiem Rubidium Down (Cesio i Francio).
W kryształach Rubidio BCC ich atomy RB oddziałują ze sobą dzięki metalowej linku. Jest to rządzone przez „morze elektronów” jego warstwy walencyjnej, z orbity 5s zgodnie z jego konfiguracją elektroniczną:
[Kr] 5s1
Wszystkie orbitale 5s z ich jedynym elektronem nakładają się we wszystkich wymiarach kryształów metalu Rubidio. Jednak interakcje te są słabe, ponieważ w miarę opuszczenia grupy metali alkalicznych, orbitale stają się bardziej rozproszone, a zatem połączenie metaliczne osłabia.
Dlatego temperatura topnienia Rubidium wynosi 39 ° C. Ponadto jego słaba metalowa więź wyjaśnia miękkość jej stałego; tak miękkie, że wydaje się, że jest to srebrne masło.
Nie ma wystarczającej ilości informacji bibliograficznych dotyczących zachowania ich kryształów pod wysokim naciskiem; Jeśli istnieją najbardziej gęsta fazy o unikalnych właściwościach, jak w przypadku sodu.
Liczby utleniania
Jego konfiguracja elektroniczna raz wskazuje, że Rubidium silnie traci swój jedyny elektron, aby stać się izolektronicznym i szlachetnym gazem Kripton. Kiedy tak, monowalentne kation powstaje RB+. Mówi się, że w swoich związkach ma numer utleniania +1, gdy zakłada się istnienie tego kationu.
Ze względu na trend Rubidium do utleniania, założenie, że istnieją jony RB+ W swoich związkach odnosi sukcesy, co z kolei wskazuje na charakter jonowy tych związków.
W prawie wszystkich związkach Rubidium wykazuje liczbę utleniania +1. Przykłady są następujące:
-Chlorek Rubid, RBCL (RB+Cl-)
-Rubidio wodorotlenek, RBOH (RB+ Oh-)
-Rubidio węglan, RB2WSPÓŁ3 (RB2+WSPÓŁ32-)
-Rubidio tlenek, RB2Lub (RB2+ALBO2-)
-Rubidium nadtlenek, RBO2 (RB+ALBO2-)
Nawet jeśli jest to bardzo rzadkie, Rubidium może również mieć ujemną liczbę utleniania: -1 (RB-). W tym przypadku rozmawialibyśmy o „Rubidiuro”, gdyby utworzył związek z mniejszym elementem elektroonegatywnym niż on, lub jeśli zgłosił się w specjalnych i rygorystycznych warunkach.
Klastry
Istnieją związki, w których każdy atom RB ma liczby utleniania o wartościach ułamkowych. Na przykład w RB6Lub (RB62+ALBO2-) i Rb9ALBO2 (RB94+ALBO22-) Obciążenie dodatnie jest rozmieszczone między zestawem atomów RB (klastry). Zatem w RB6Lub liczba utleniania teorii wynosiłaby +1/3; podczas gdy w RB9ALBO2, + 0,444 (4/9).
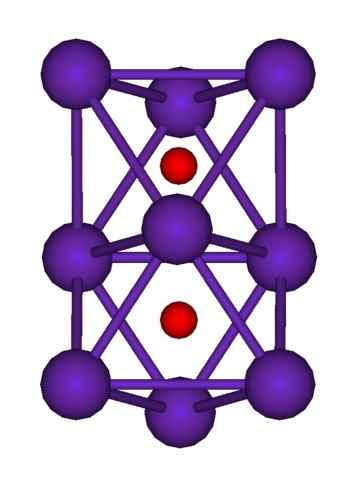 Struktura klastra RB9O2. Źródło: Axiosaurus [domena publiczna]
Struktura klastra RB9O2. Źródło: Axiosaurus [domena publiczna] Struktura klastra RB pokazano powyżej9ALBO2 reprezentowane przez model sfer i słupków. Zwróć uwagę, jak dziewięć atomów RB „otacza” aniony lub2-.
Zgodnie z wyjaśnieniem, jest tak, jakby część oryginalnych metalowych kryształów Rubidium pozostała niezmieniona podczas oddzielania się od kryształu matki. W trakcie tracą elektrony; te niezbędne do przyciągnięcia OR2-, a wynikowy ładunek dodatni jest rozkładany między wszystkimi atomami wspomnianego klastra (zestaw lub agregaty atomów RB).
Zatem w tych klastrach Rubidium nie można formalnie założyć istnienia RB+. RB6Lub RB9ALBO2 Klasyfikują jako podtlenki Rubidium, w których ta pozorna anomalia jest spełniona, aby mieć nadmiar atomów metalu w odniesieniu do tlenków anionów.
Gdzie to jest i uzyskaj
Skorupa ziemska
 Próbka mineralna lepidolit. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Próbka mineralna lepidolit. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Rubidio jest najliczniejszym elementem 23 skorupy ziemskiej, z obfitością porównywalną z obfitością cynku, ołowiu, cezu i miedzi. Szczegółem jest to, że ich jony są szeroko rozpowszechniane, więc nie przeważają się w żadnym minerału jako główny element metaliczny, a ich ruda są również rzadkie.
Może ci służyć: Grignard Reagent: przygotowanie, aplikacje, przykładyZ tego powodu Rubidio jest bardzo drogim metalem, nawet bardziej niż to samo złoto, ponieważ jego proces uzyskiwania z jego menas jest złożony ze względu na trudność jego wykorzystania.
W naturze, biorąc pod uwagę jego reaktywność, Rubidium nie jest w stanie rodzimym, ale jako tlenek (RB2O), chlorek (RBCL) lub w towarzystwie innych anionów. Jego „wolne” jony RB+ Są na morzu ze stężeniem 125 µg/l, a także w gorących źródłach i rzekach.
Wśród minerałów skorupy ziemskiej, które zawierają ją w stężeniu mniejszym niż 1%:
-Leucita, K [Alsi2ALBO6]
-Polucita, CS (tak2Cześć6· NH2ALBO
-Carnalita, Kmgcl3· 6H2ALBO
-Zinnwaldita, Klifeal (Alsi3)ALBO10(Och, F)2
-Amazonita, PB, Kalsi3ALBO8
-Petalita, Lialsi4ALBO10
-Biotita, K (Mg, Faith)3Alsi3ALBO10(Och, F)2
-Rubiclina, (RB, K) Alsi3ALBO8
-Lepidolita, K (Li, Al)3(Tak, Al)4ALBO10(F, OH)2
Stowarzyszenie geochemiczne
Wszystkie te minerały mają wspólną jedną lub dwie rzeczy: są to potas, cez lub lit krzemiany lub są solami mineralnymi z tych metali.
Oznacza to, że Rubidio ma silną tendencję do kojarzenia się z potasem i cesio; Może nawet zastąpić potas podczas krystalizacji minerałów lub skał, jak to się dzieje na polach pegmatitas, gdy magma krystalizuje. Zatem Rubidio jest produktem ubocznym wyzysku i rafinacji tych skał i ich minerałów.
Rubidio może być również we wspólnych skałach, takich jak granit, gliny i bazalt, a nawet złogi karboński. Ze wszystkich naturalnych źródeł lepidolit reprezentuje swoją główną rudę i z której jest wykorzystywany komercyjnie.
Z drugiej strony w ciele, Rubidio można znaleźć jako zanieczyszczenia RBCL o zawartości 0,035%. A w większym stężeniu znajdują się złóż policytas i rubiclinas, które mogą mieć do 17% Rubidium.
Jego powiązanie geochemiczne z potasem wynika z podobieństwa jego radiotelefonów; RB+ jest większy niż k+, Ale różnica w rozmiarach nie jest przeszkodą dla pierwszego, który zastąpił drugą w swoich kryształach mineralnych.
Krystalizacja ułamkowa
Niezależnie od tego, czy jest on oparty na lepidolite, czy policycie, czy o dowolnym z wyżej wymienionych minerałach, wyzwanie pozostaje takie samo w większym lub mniejszym stopniu: oddzielenie Rubidium od potasu i cesium; to znaczy zastosuj techniki rozdzielenia mieszaniny, które pozwalają z jednej strony związki lub sole rubidium, a z drugiej strony potasu i cezu.
Jest to trudne od tych jonów (k+, RB+ i CS+) dzielić wielkie podobieństwo chemiczne; Reagują w ten sam sposób, tworząc te same sole, które ledwo się od siebie różnią dzięki gęstościom i rozpuszczaniu. Dlatego stosuje się frakcjonowaną krystalizację, aby mogły powoli i kontrolować.
Na przykład ta technika służy do oddzielenia mieszanki węglanów i absolwentów od tych metali. Procesy rekrystalizacji należy powtórzyć kilkakrotnie, aby zagwarantować ostateczne i wolne kryształy jonów koprecitowanych; Sól rubidium, która krystalizuje jony k+ lub Cs+ na jego powierzchni lub wewnątrz.
Bardziej nowoczesne techniki, takie jak stosowanie żywicy jonowej lub korony jako złożonych agentów, pozwalają również na jony RB+.
Elektroliza lub redukcja
Gdy możliwe było oddzielenie i oczyszczenie soli rubidowej, następnym i ostatnim krokiem jest zmniejszenie kationów RB+ do stałego metalu. Aby to zrobić, sól topi się i jest poddawana elektrolizy w celu wytrącania rubidium w katodzie; lub stosuje się silny środek redukujący, taki jak wapń i sód.
Izotopy
Rubidio znajduje się na ziemi jako dwa naturalne izotopy: 85RB i 87RB. Pierwszy ma obfitość 72,17%, podczas gdy drugie 27,83%.
On 87RB jest odpowiedzialny za radioaktywny metal; Jednak jego promieniowanie jest nieszkodliwe, a nawet korzystne w analizie randek. Twoja pół -life (T1/2) wynosi 4,9 · 1010 lata, których okres przekracza wiek wszechświata. Kiedy rozpada się, staje się stabilnym izotopem 87Pan.
Dzięki temu izotop ten był używany do czasu wieku minerałów i skał lądowych obecnych od początku Ziemi.
Oprócz izotopów 85RB i 87RB, istnieją inne syntetyczne i radioaktywne o zmiennych i znacznie krótszym czasie życia; Na przykład on 82RB (T1/2= 76 sekund), 83RB (T1/2= 86,2 dni), 84RB (T1/2= 32,9 dni) i 86RB (T1/2= 18,7 dni). Wszystkich z nich, 82RB jest najczęściej stosowany w badaniach medycznych.
Ryzyko
Metal
Rubidio jest metalem tak reaktywnym, że musi być przechowywany w szklanych ampułkach w obojętnej atmosferze, aby nie reagował z tlenem powietrza. Jeśli wspomniany ampułka pęknie, metal można umieścić w naftach lub oleju mineralnym, aby go chronić; Jednak ostatecznie utlenia w nich rozpuszczony tlen, powodując nadtlenki Rubidium.
Może ci służyć: cyjanku sodu (nacn): struktura, właściwości, ryzyko, zastosowaniaJeśli wręcz przeciwnie, zdecydowano na przykład na drewnie, skończy się płonące. Jeśli jest dużo wilgoci, spali się z samym faktem, że będzie narażony na powietrze. Kiedy unika się dużego kawałka rubidium przy objętości wody, wykorzystuje energicznie, docierając do wodoru w ogniu.
Dlatego Rubidium jest metalem, który powinien manipulować, ponieważ wszystkie jego reakcje są praktycznie wybuchowe.
Jony
W przeciwieństwie do metalicznego Rubidium, jego jony RB+ Nie reprezentują żadnego pozornego ryzyka dla żywych istot. Te rozpuszczone w wodzie oddziałują z komórkami w taki sam sposób, jak jony k+.
Dlatego Rubidium i potas mają podobne zachowania biochemiczne; Jednak Rubidium nie jest niezbędnym elementem, podczas gdy potas tak. W ten sposób znaczne kwoty RB+ Mogą gromadzić się we wnętrzach komórek, czerwonych krwinek i wnętrzności bez negatywnego wpływu na ciało jakiegokolwiek zwierzęcia.
W rzeczywistości oszacowano, że dorosły mężczyzna o masie 80 kg zawiera około 37 mg Rubidio; A ponadto wzrost tego stężenia w rzędu 50 do 100 razy nie prowadzi do niepożądanych objawów.
Jednak nadmiar jonów RB+ może ostatecznie przejść do jonów k+; I w konsekwencji jednostka będzie cierpieć bardzo silne skurcze mięśni do śmierci.
Logicznie, sole szatowiskowe lub związki Rubidium mogą to natychmiast wywołać, więc żaden z nich nie powinien być połknięty. Ponadto może powodować proste oparzenia kontaktowe i wśród najbardziej toksycznych fluoru (RBF), wodorotlenku (RBOH) i cyjanku (RBCN) Rubidium.
Aplikacje
Kolekcjoner gazu
Rubidio został wykorzystany do przechwytywania lub wyeliminowania śladów gazów, które mogą istnieć w uszczelnionych rurkach próżniowych. Właśnie ze względu na ich wysoką tendencję do wychwytywania w nich tlenu i wilgoci, eliminują je na powierzchni jako nadtlenki.
Pirotechnika
Kiedy sole w Rubidio spalają charakterystyczny fioletowo-czerwonawy płomień. Niektóre fajerwerki mają te sole w swoim składzie, aby eksplodowały tymi kolorami.
Suplement
Chlorek Rubidio został przepisany w celu zwalczania depresji, ponieważ badania określiły deficyt tego pierwiastka u osób cierpiących na tę chorobę. Był również stosowany jako środek uspokajający i leczyć padaczkę.
Kondensat Bose-Einstein
Atomy izotopowe 87RB zastosowano do stworzenia pierwszego kondensatu Bose-Einsteina. Ten stan materii polega na tym, że atomy w temperaturze dość zbliżone do bezwzględnego zera (0 K) są zgrupowane lub „kondensan”, zachowując się tak, jakby były jednym.
Tak więc Rubidio był bohaterem tego triumfu w dziedzinie fizyki, a to Eric Cornell, Carl Wieman i Wolfgang Ketterle otrzymali Nagrodę Nobla w 2001 roku dzięki tej pracy dzięki tej pracy.
Diagnoza nowotworu
Syntetyczny radioizotop 82RB rozpada się przez emitujące pozytrony, które jest używane do gromadzenia się w tkankach potasowych; Podobnie jak te znajdujące się w mózgu lub sercu. Jest zatem stosowany do analizy funkcjonalności serca i obecności możliwych guzów w mózgu poprzez pozytronową tomografię emisyjną.
Część
Jony Rubidio znalazły miejsce w różnych rodzajach materiałów lub mieszanin. Na przykład wykonano ich stopy ze złotem, cezem, rtęcią, sodem i potasem. Został dodany do szkła i ceramiki, aby prawdopodobnie zwiększyć ich temperaturę topnienia.
W ogniwach słonecznych Perovskitas zostały dodane jako ważny składnik. Podobnie, jego możliwe zastosowanie zostało zbadane jako generator termoelektryczny, materiał transmisji cieplnej w przestrzeni, paliwo w jonowych silnikach napędowych, pożywce elektrolityczne dla akumulatorów alkalicznych i magnetometrów atomowych.
Zegarki atomowe
Z Rubidium i Scases słynne zegarki atomowe zostały wyprodukowane, bardzo precyzyjne, na przykład w satelitach GPS, z którymi właściciele ich smartfonów mogą poznać swoją lokalizację podczas poruszania się po drodze.
Bibliografia
- Bond Tom. (29 października 2008 r.). Rubid. Odzyskane z: ChemistryWorld.com
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Rubid. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Rubid. Baza danych Pubchem. CID = 5357696. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Chellan, s. 1., & Sadler, p. J. (2015). Elementy życia i leków. Transakcje filozoficzne. Seria A, Nauk o matematyce, fizycznej i inżynierii, 373 (2037), 20140182. Doi: 10.1098/RSTA.2014.0182
- May Foundation for Medical Education and Research. (2019). Rubidium RB 82 (trasa dożylna). Odzyskane z: Mayoclinic.org
- Marques Miguel. (S.F.). Rubid. Odzyskane z: Nautilus.Fis.UC.Pt
- James L. Barwnik. (12 kwietnia 2019). Rubid. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Dr. Doug Stewart. (2019). Fakty elementów Rubidium. Chemicool. Odzyskane z: Chemicool.com
- Michael Pilgaard. (10 maja 2017 r.). Reakcje chemiczne Rubidium. Odzyskane z: Pilgaardelelegs.com

