Redukcja (chemia)
- 2387
- 585
- Estera Wojtkowiak
 Redukcja drzewa srebra. Źródło: Gabriel Bolívar
Redukcja drzewa srebra. Źródło: Gabriel Bolívar Jaka jest redukcja?
zmniejszenie To wszystko ta reakcja chemiczna, w której atomy jednej z odczynników kończą zyskanie elektronów, co można również zobaczyć w ten sposób: jego wakat lub „dyskomfort elektroniczny” jest zmniejszony. Atom zyskuje elektrony, gdy gatunek je przekazuje, to znaczy po utlenianiu.
Tego rodzaju reakcja nie może być sama nadana: jeśli gatunek przyjmuje elektrony, inny musi je dać. W przeciwnym razie materia zostałaby utworzona z niczego, zmniejszając atomy po uzyskaniu pustych elektronów. Dlatego jest to pół -światło redoks (redukcja/utlenianie).
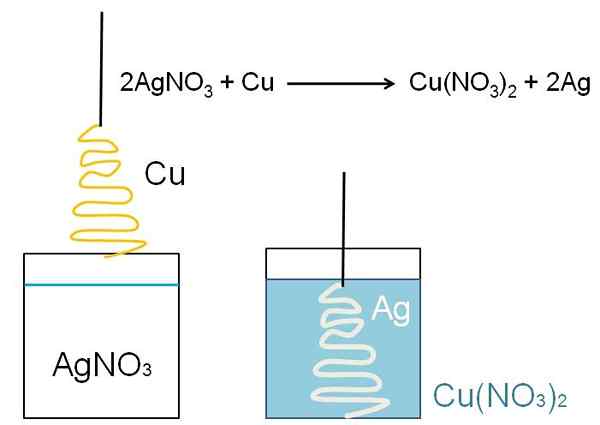
Ilustracyjnym przykładem redukcji, którą można pokazać w klasach klasowych, jest reakcja między metalową powierzchnią miedzi i wodnym roztworem azotanu srebra, Agno3.
W roztworze srebro jest jak kation+, dodatnio załadowane. Te, podczas interakcji z powierzchnią miedzi, w postaci choinki, elektrony są pobierane z miedzianych atomów. Kiedy to nastąpi, miedź zastępuje srebro w soli azotanu, w wyniku czego powstaje azotan miedzi, nie3)2.
Katacje Cu2+ obok nie3- Ocelewają roztwór, a srebro ucieleśnia choinkę, jakby zakrywa ją śniegiem.
Jaka jest redukcja?
W ramach redukcji już powiedziano, że gatunek zyskuje elektrony. Jak można to sprawdzić w równaniu chemicznym? Na przykład w równaniu reakcji między Cu i Agno3, Jak wiedzieć, kiedy nastąpi redukcja? Aby to zweryfikować, konieczne jest określenie liczby lub statusu utleniania.
Może ci służyć: elektroonycznośćElementy w swoich stanach naturalnych mają jako definicję stan utleniania równy zero, ponieważ zakłada się, że nie przegrali ani nie wygrały elektronów. Zatem metale stałe mają stan zerowy utlenianie. Zatem srebro przechodzi z +1 (ag+) A 0 (ag). Obciążenie jonu metalu jest równe jego stanowi utleniania.
Z drugiej strony elektrony pochodziły z miedzi: przechodzenie z 0 (cu) do +2 (cu2+). Anion azotanowy, nie3- pozostaje niezmienione, podczas gdy oba metale wymieniają elektrony. Dlatego równanie można zapisać jako:
2ag+ + Cu => 2ag + cu2+
Zauważ, że zarówno obciążenia, jak i atomy są zrównoważone.
Składa się to z redukcji chemicznej: przy wzmocnieniu elektronów, które sprawiają, że stany utleniania atomów, które elektrony zarabiają.
Liczba tlenu
Tlen są bardzo elektroonywacyjne i utleniające atomy, więc gdy powstanie z nimi atom (takie jak tlenki), mają dodatnie stany utleniania. Im większa liczba tlenu oddziałującego z atomem, tym bardziej dodatnie będzie jego utlenianie. Lub co jest takie samo, jest bardziej utleniony.
Dlatego, gdy związek ma mniej atomów tlenu, mówi się, że jest mniej utleniony. To znaczy atom traci mniej elektronów.
Klasyczny przykład można zaobserwować w tlenku i dwutlenku węgla. W przypadku CO, węgiel ma stan utleniania +2, podczas gdy dla CO₂ jego stan utleniania wynosi +4.
Tak więc, jeśli w reakcji CO₂ jest przekształcana w CO, mówi się, że dzieje się redukcja, ponieważ węgiel oddziałuje teraz z tlenem, a nie dwoma. W przypadku przeciwnej reakcji, transformacji, mówi się o utlenianiu węgla.
Może ci służyć: chlorek żelazny (FECL2): struktura, zastosowania, właściwościDotyczy to wszystkich atomów, zwłaszcza metali w ich tlenkach metali. Na przykład cro2 (Cr4+) i cro3 (Cr6+).
W równaniach chemicznych, w których gatunek traci tlen, podczas gdy inne gatunki go zarabiają, mówi się, że zachodzi transfer tlenu.
Atom elektroonegatywny
Zawsze można ustalić, czy nastąpiła redukcja poprzez zmianę statusu utleniania na mniejszą wartość dodatnią. Jak właśnie wyjaśniłeś, szybkim sposobem na zauważenie go bez wykonywania obliczeń jest obserwowanie, czy następuje spadek atomów tlenu w związku.
To samo może się zdarzyć z każdym innym atomem, który jest bardziej elektroongeneracyjny niż atom, który wygrywa lub traci elektrony.
Na przykład, jeśli CF4 reaguje w taki sposób, że staje się Cho4, Mówi się zatem, że nastąpiła redukcja, ponieważ fluor jest znacznie bardziej elektroungcyjny niż atom wodoru. W rezultacie węgiel jest mniej utleniony w Cho4 że w CF4, To samo mówi, że został zmniejszony.
Przykłady
Zmniejszenie chemii organicznej
Przykład CF4 i rozdz4 odzwierciedla to, co dzieje się w reakcjach organicznych, gdzie zmniejszenie częściowego obciążenia atomu jest uważane za wzmocnienie elektroniczne. Dotyczy to znacznego rozważania zmniejszenia natlenionych grup funkcjonalnych.
Weźmy na przykład grupy ROH, RCHO i COOH. Pierwszy odpowiada alkoholom, w których węgiel jest powiązany z tlenem (C-OH); Druga to grupa aldehydu, w której węgiel tworzy podwójne wiązanie z tlenem i jest również powiązane z wodorem (C = O-H), a trzecia to grupa karboksylowa.
Może ci służyć: wodorotlenek berylowy (be (OH) 2)W grupie karboksylowej węgiel tworzy podwójne wiązanie z O i prosty związek z innym O (HO-C = O).
Dlatego zmniejszenie występuje, jeśli kwas karboksylowy zostanie przekształcony w alkohol:
Rcooh => roh
Ekstrakcja metalu
Redukcja chemiczna jest niezwykle ważna w procesach ekstrakcji metali z ich minerałów. Niektóre reakcje to:
HGS + O2 => HG + SO2
Siarczek rtęci jest redukowany do metalicznego rtęci.
Cu2S + o2 => 2CU + SO2
Siar miedzi do metalicznej miedzi jest zmniejszony.
2zns + 3o2 => 2ZNO + 2SO2
ZnO + C => Zn + CO (Zwróć uwagę na przeniesienie O).
Siarczek cynkowy jest najpierw zredukowany do jego tlenku, a następnie do jego metalicznego kształtu.
Wiara2ALBO3 + 3co => 2fe + 3co2
Tlenek żelaza jest redukowana do żelaza metalicznego.
Wo3 + 3H2 => W + 3H2ALBO
A trutlenek wolframowy jest zredukowany do metalicznego wolframu.
Jako ćwiczenie, liczbę utleniania metalu można określić przed zmniejszeniem.
Inne przykłady
- Jon żelaza (III) można zmniejszyć do żelaza (II):
- Etino można zmniejszyć do Eteno:
- Etanal można zmniejszyć do etanolu
Bibliografia
- Reakcje ograniczania utleniania. Chem wyzdrowiał.Librettexts.org.
- Definicja zmniejszenia chemii. Wyzdrowiał z Thoughco.com.




