Reakcje chemiczne Charakterystyka, części, typy, przykłady

- 2338
- 620
- Pani Gilbert Stolarczyk
reakcje chemiczne Są to zmiany, które mają znaczenie w zamawianiu ich atomów i odbywają się, gdy zetkną się dwie różne substancje lub związki. W procesie zmian, które można natychmiast postrzegać; takie jak wzrost temperatury, chłodzenie, tworzenie gazu, błyski lub opady ciała stałe.
Najczęstsze reakcje chemiczne często pozostają niezauważone w życiu codziennym; Tysiące z nich są przeprowadzane w naszym ciele. Inne są jednak bardziej widoczne, ponieważ możemy je wykonać w kuchni, wybierając prawidłowe przybory i składniki; Na przykład wymieszaj wodorowęglan z octem, cukier w wodzie lub zakwaszić sok z Colorad.
 Reakcja wodorowęglanu i octu jest przykładem nawracającej reakcji chemicznej w kuchni. Źródło: Kate ter Har (https: // www.Flickr.com/Photo/Katerha/5703151566)
Reakcja wodorowęglanu i octu jest przykładem nawracającej reakcji chemicznej w kuchni. Źródło: Kate ter Har (https: // www.Flickr.com/Photo/Katerha/5703151566) W laboratoriach reakcje chemiczne stają się bardziej zwykle i powszechne; Wszystkie występują w zlewkach (zlewki) lub kolbach Erlenmeyer. Jeśli podzielają wspólną, żaden nie jest prosty, ponieważ ukrywają zderzenia, pęknięcia linków, mechanizmy, tworzenie linków, energia i aspekty kinetyczne.
Istnieją reakcje chemiczne tak uderzające, że fani i naukowcy, znając toksykologię odczynników i niektóre miary bezpieczeństwa, odtwarzają je w dużych skalach w fascynujących działaniach demonstracyjnych.
[TOC]
Koncepcja reakcji chemicznej
Reakcje chemiczne odbywają się, gdy istnieje złamanie łącza (jonowego lub kowalencyjnego), tak aby na miejscu powstał inny; Dwa atomy lub ich zestaw przestają silnie oddziaływać, aby spowodować nowe cząsteczki. Dzięki temu można określić właściwości chemiczne związku, jego reaktywność, stabilność, z tym, co reaguje.
Oprócz odpowiedzialności za reakcje chemiczne, które sprawa stale się przekształca, bez ich atomów, wyjaśniają pojawienie się związków, które znamy.
Aby linki do złamania, energia jest wymagana, a po utworzeniu linków jest zwolniona. Jeśli wchłonięta energia jest większa niż uwolniona, mówi się, że reakcja jest endotermiczna; Mamy okoliczne chłodzenie. Podczas gdy uwolnione ciepło jest lepsze od absorbowania, będzie to reakcja egzotermiczna; Otoczenie jest ogrzewane.
Charakterystyka reakcji chemicznych
Kinetyka
Cząsteczki teorii muszą współpracować ze sobą, niosąc ze sobą wystarczającą energię kinetyczną, aby sprzyjać złamaniu linku. Jeśli twoje zderzenia są powolne lub nieefektywne, reakcja chemiczna jest dotknięta kinetycznie. Może się to zdarzyć albo w stanie fizycznym substancji, albo przez geometrię lub strukturę tego samego.
Zatem w reakcji materia jest przekształcana przez wchłanianie lub uwalnianie ciepła, podczas gdy cierpiąc kolizje, które sprzyjają tworzeniu produktów; Najważniejsze składniki każdej reakcji chemicznej.
Masowa ochrona
Z powodu prawa ochrony masowej całkowita masa zestawu pozostaje stała po reakcji chemicznej. Zatem suma poszczególnych mas każdej substancji jest równa masie uzyskanego wyniku.
Zmiany fizyczne i/lub zmiany stanu
Występowaniu reakcji chemicznej może towarzyszyć zmiana stanu składników; to znaczy zmienność stanu stałego, ciekłego lub gazowego materiału.
Jednak nie wszystkie zmiany stanu oznaczają reakcję chemiczną. Na przykład: Jeśli woda odparowuje z powodu ciepła, pary wody wytwarzane po tej zmianie stanu pozostaje wodą.
Wariacja kolorów
Wśród fizycznych atrybutów wynikających z reakcji chemicznej wyróżnia się zmiana koloru odczynników w porównaniu z kolorem produktu końcowego.
Zjawisko to jest znaczące podczas obserwowania reakcji chemicznej metali z tlenem: gdy metal jest utleniony, zmienia swój charakterystyczny kolor (złoto lub srebro, jak to możliwe), aby stać się pomarańczowo-rdzeniowym tonem, znanym jako rdza.
Uwolnienie gazu
Ta cecha przejawia się jako bulgotanie lub emisja poszczególnych zapachów.
Zasadniczo pęcherzyki pojawiają się w wyniku złożenia cieczy w wysokich temperaturach, co zachęca do wzrostu energii kinetycznej cząsteczek, które są częścią reakcji.
Zmiany temperatury
W przypadku, gdy ciepło jest katalizatorem reakcji chemicznej, zmiana temperatury zostanie indukowana w produkcie końcowym. Dlatego wprowadzanie ciepła i wyjście w procesie może być również charakterystyczne dla reakcji chemicznych.
Części reakcji chemicznej
Odczynniki i produkty
Dowolna reakcja chemiczna jest reprezentowana przez równanie typu:
A + B → C + D
Gdzie A i B są reagentami, podczas gdy C i D produkty. Równanie mówi nam, że atom lub cząsteczka A reaguje z B, powodując produkty C i D. Jest to nieodwracalna reakcja, ponieważ reagenty nie mogą pochodzić z produktów. Zamiast tego poniższa reakcja jest odwracalna:
A + B C + D
Ważne jest, aby podkreślić, że masa reagentów (A+B) musi być równa masy produktów (C+D). W przeciwnym razie ciasto nie zostanie zachowane. Podobnie, liczba atomów dla danego elementu musi być taka sama przed i po strzałce.
Powyżej strzałki wskazuje pewne specyfikacje reakcji: temperatura (δ), częstość występowania promieniowania ultrafioletowego (Hv) lub używany katalizator.
Może ci służyć: szkło zegaraOznacza reakcję
W odniesieniu do życia i reakcji występujących w naszym ciele, medium reakcji jest wodne (AC). Jednak reakcje chemiczne można opracować w dowolnym ciekłym pożywce (etanolu, lodowatego kwasu octowego, toluenu, tetrahydrofuranie itp.) Tak długo, jak odczynniki są dobrze rozpuszczone.
Pojemniki lub reaktory
Kontrolowane reakcje chemiczne występują w pojemniku, czy to prosty materiał szklany, czy w reaktorze ze stali nierdzewnej.
Rodzaje reakcji chemicznych
Rodzaje reakcji chemicznych opierają się na tym, co dzieje się na poziomie molekularnym; Jakie linki pękają i jak kończą się atomy. Weźmie się również pod uwagę, czy gatunki zyskują, czy tracą elektrony; Nawet gdy dzieje się to w większości reakcji chemicznych.
Oto różne rodzaje istniejących reakcji chemicznych.
- Redukcja utleniania (Rédox)
Utlenianie miedzi
W przykładzie patyny zachodzi reakcja utleniania: Metalowa miedź traci elektrony w obecności tlenu, aby przekształcić się w odpowiedni tlenek.
4CU (s) + o2(g) => cu2Ty)
Tlenek miedzi (i) nadal utlenia się, aby podać tlenek miedzi (II):
2CU2Lub (s) + lub2 => 4CUO (S)
Ten rodzaj reakcji chemicznej, w której gatunki rosną lub zmniejszają liczbę utleniania (lub status), jest znany jako reakcja utleniania i redukcji (Rédox).
Metalowa miedź ze stanem utleniania 0, najpierw traci elektron, a następnie drugi (utlenia się), podczas gdy tlen pozostaje (jest zmniejszony):
Cu => cu+ + I-
Cu+ => Cu2+ + I-
ALBO2 + 2e- => 22-
Przyrost lub utratę elektronów można określić poprzez obliczenie liczby utleniania dla atomów w wzorach chemicznych ich powstałych związków.
Dla Cu2Lub wiadomo, że ponieważ jest to tlenek, ma anion lub2-, Aby zachować obciążenia zneutralizowane, każde z dwóch atomów miedzianych musi mieć obciążenie +1. Bardzo podobne występuje z CUO.
Miedź, gdy utleniona nabywa dodatnie liczby utleniania; i tlen, do zmniejszenia, ujemne liczby utleniania.
Żelazo i kobalt
Dodatkowe przykłady reakcji pokazano poniżej. Podobnie zostanie wprowadzony krótki komentarz, a zmiany liczb utleniania zostaną określone.
Fecl2 + Cocl3 => FECL3 + Cocl2
Jeśli liczby utleniania zostaną obliczone, można zauważyć, że liczby CL pozostają o stałej wartości -1; Nie z uwidaniem i spółką.
Na pierwszy rzut oka żelazo utleniło się, podczas gdy kobalt został zmniejszony. Jak wiedzieć? Ponieważ żelazo oddziałuje teraz nie z dwoma Cl- ale z trzema, będąc najbardziej elektroonywentnym atomem chloru niż żelazo i kobalt. Z drugiej strony, jest odwrotnie Cobalt: wynika z interakcji z trzema Cl- Do dwóch z nich.
Jeśli poprzednie rozumowanie nie jest jasne, zapisane są równania chemiczne transferu elektronów netto:
Wiara2+ => Wiara3+ + I-
Współ3+ + I- => Co2+
Dlatego wiara2+ Utlenia się, a CO3+ jest zmniejszone.
Jod i mangan
6 kmno4 + 5KI + 18HCl => 6mncl2 + 5Kio3 + 6kcl+ 9h2ALBO
Chemikalia powyżej może wydawać się skomplikowana, ale tak nie jest. Chlor (CL-) nie tlen (lub2-) doświadczyć zysku lub utraty ich elektronów. Jod i mangan, tak.
Biorąc pod uwagę tylko związki z jodem i manganem, masz:
Ki => kio3 (Numer utleniania: -1 do +5, traci sześć elektronów)
Kmno4 => Mcl2 (Numer utleniania: +7 do +2, wygrywa pięć elektronów)
Jod utlenia się, podczas gdy mangan jest zmniejszony. Jak wiedzieć bez obliczania? Ponieważ jod przechodzi od bycia potasem do interakcji z trzema tlenem (bardziej elektroujemnie); A w międzyczasie mangan traci interakcje z tlenem z chlorem (mniej elektroungatywne).
Ki nie może stracić sześciu elektronów, jeśli kmno4 Wygraj pięć; Dlatego liczba elektronów musi być zrównoważona w równaniu:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Który powoduje przeniesienie netto 30 elektronów.
Spalanie
Spalanie to energiczne i energetyczne utlenianie, w którym uwalniane są światło i ciepło. Zasadniczo w tego rodzaju reakcji chemicznej tlenu uczestniczy jako środek utleniający lub kombinacyjny; Podczas gdy czynnik redukujący jest paliwo, które pali się na końcu konta.
Tam, gdzie są popioły, było spalanie. Składają się one z tlenków węgla i metali; Chociaż jego skład logicznie zależy od tego, czym było paliwo. Poniżej kilka przykładów:
C (s) + o2(g) => co2(G)
2co (g) + lub2(g) => 2co2(G)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Każde z tych równań odpowiadają pełnym spalaniu; Oznacza to, że całe paliwo reaguje z nadmiarem tlenu, aby zagwarantować jego całkowitą transformację.
Należy również zauważyć, że CO2 i H2Lub są to produkty większości gazowych, gdy pali się węglowe ciała (takie jak drewno, węglowodory i tkanki zwierzęce). Jest nieuniknione, że powstanie niektórych alotropowych węgla, z powodu niewydolności tlenu, a także mniej natlenionych gazów, takich jak CO i nie.
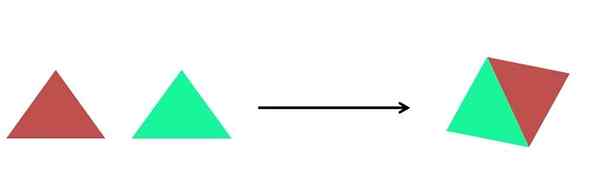
- Synteza
 Graficzna reprezentacja reakcji syntezy. Źródło: Gabriel Bolívar.
Graficzna reprezentacja reakcji syntezy. Źródło: Gabriel Bolívar. Na obrazie wyższym pokazano bardzo prostą reprezentację. Każdy trójkąt jest związek lub atom, który łączy się, tworząc pojedynczy związek; Dwa trójkąty tworzą równoległobok. Masy rosną, a właściwości fizyczne i chemiczne produktu są często bardzo różne od właściwości ich odczynników.
Może ci służyć: entalpiaNa przykład spalanie wodoru (która jest również reakcją Rédox), wytwarza tlenek wodoru lub wodorot tlenu; lepiej znany jako Agua:
H2(g) + lub2(g) => 2h2O (g)
Mieszając oba gazy, w wysokiej temperaturze, spal wodę wytwarzającą gazę. Chłodzone temperatury, opary kondensują się, aby dać ciekłą wodę. Kilku autorów uważa tę reakcję syntezy za jedną z możliwych alternatyw zastępowania paliw kopalnych w uzyskiwaniu energii.
Linki H-H i O = o są zepsute, aby utworzyć dwa nowe proste linki: H-O-H. Woda, jak dobrze wiadomo, jest niezrównaną substancją (poza zmysłem romantycznym), a jej właściwości różnią się bardzo od gazowego wodoru i tlenu.
Związki jonowe
Powstawanie związków jonowych z jego pierwiastków jest również przykładem reakcji syntezy. Jednym z najprostszych jest tworzenie metalowych halgenurosów grup 1 i 2. Na przykład synteza bromku wapnia:
CA (s) + BR2(L) => Cabr2(S)
Ogólne równanie tego rodzaju syntezy to:
M (s) + x2 => MX2(S)
Koordynacja
Gdy utworzony związek obejmuje atom metaliczny w geometrii elektronicznej, mówi się, że jest to złożone. W kompleksach metale pozostają zjednoczone z ligandem przez słabe wiązania kowalencyjne i są tworzone przez reakcje koordynacyjne.
Na przykład masz kompleks [Cr (NH3)6]3+. Powstaje to podczas kationu3+ jest w obecności cząsteczek amoniaku, NH3, które działają jako chromowane ligandowie:
Cr3+ + 6nh3 => [Cr (NH3)6]3+
Poniżej znajduje się wynikająca z koordynacji oktaedron wokół Chrome Metal Center:
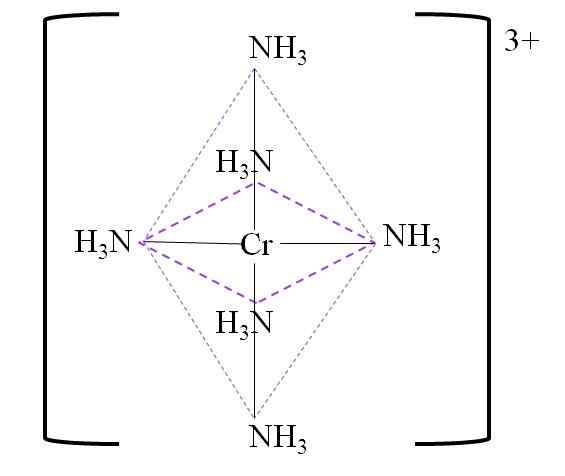 Koordynacja oktaedron dla kompleksu. Źródło: Gabriel Bolívar.
Koordynacja oktaedron dla kompleksu. Źródło: Gabriel Bolívar. Należy zauważyć, że obciążenie chrom 3+ nie jest neutralizowane w kompleksie. Jego kolor jest fioletowy i dlatego oktahedron jest reprezentowany wspomnianym kolorem.
Niektóre kompleksy są bardziej interesujące, jak w przypadku niektórych enzymów, które koordynują atomy żelaza, cynku i wapnia.
- Rozkład
Rozkład staje się przeciwieństwem syntezy: związek pęka na jeden, dwa lub trzy elementy lub związki.
Na przykład istnieją następujące trzy rozkłady:
2HGO (s) => 2Hg (l) + o2(G)
2h2ALBO2(L) => 2h2Lub (l) + o2(G)
H2WSPÓŁ3(ac) => co2(g) + h2Lub (l)
HGO jest czerwonawą substancją stałą, która przez akcję cieplną pęka w metalową rtęć, czarną cieczą i tlenem.
Nadtlenek wodoru cierpi na rozkład, dając ciekłej wody i tlenu.
A tymczasem kwas węglowy rozkłada się w dwutlenku węgla i wodzie ciekłej.
Bardziej „suchy” rozkład jest ten, który cierpi z metalowymi węglanami:
Złodziej3(s) => cao (s) + co2(G)
Wulkan klasowy
 Meble amonowe wulkan dichromianu. Źródło: наталия [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Meble amonowe wulkan dichromianu. Źródło: наталия [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Reakcją rozkładu, która została zastosowana w klasach chemii, jest rozkład termiczny dichromianu amonu (NH4)2Cr2ALBO7. Ta pomarańczowa sól rakotwórcza (więc powinna być obsługiwana z wielką ostrożnością), spala się, aby uwolnić dużo ciepła i wytworzyć zielony stały, chromowy tlenek, CR2ALBO3:
(NH4)2Cr2ALBO7(s) => cr2ALBO3(s) + 4h2Lub (g) + n2(G)
- Przemieszczenie
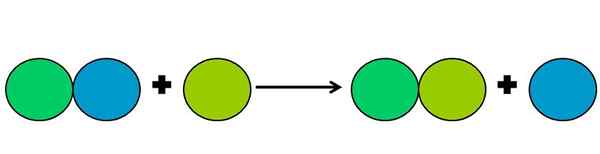 Graficzna reprezentacja reakcji przemieszczenia. Źródło: Gabriel Bolívar.
Graficzna reprezentacja reakcji przemieszczenia. Źródło: Gabriel Bolívar. Reakcje przemieszczenia są rodzajem reakcji reakcji, w której jeden element wypiera drugiego w związku. Przesunięty element kończy się zmniejszeniem lub zdobywaniem elektronów.
Aby uprościć powyższe, pokazano górny obraz. Kręgi reprezentują element. Zauważono, że zielone koło limu wypiera niebieski, będąc na zewnątrz; Ale nie tylko to, ale niebieskie okrąg jest zmniejszone, a zielona limita jest utleniona.
Wodorowy
Na przykład następujące równania chemiczne, aby ujawnić powyższe:
2al (s) + 6HCl (AC) => ALCL3(AC) + 3H2(G)
ZR (s) + 2h2Lub (g) => Zro2(s) + 2h2(G)
Zn (s) + h2południowy zachód4(ac) => znso4(AC) + H2(G)
Jaki jest przemieszczony element tych trzech reakcji chemicznych? Wodór, który jest redukowany do wodoru molekularnego, h2; przechodzi z liczby utleniania +1 do 0. Należy zauważyć, że metale aluminium, cyrkonu i cynku mogą wypierać hydrogeny kwasów i wody; Podczas gdy miedź, srebro lub złoto, nie mogą.
Metale i halogen
Podobnie te dwie dodatkowe reakcje przemieszczenia są dostępne:
Zn (s) + cuo4(ac) => cu (s) + znso4(AC)
Cl2(g) + 2NAi (ac) => 2NACL (ac) + i2(S)
W pierwszej reakcji cynk wypiera mniej aktywną metalową miedź; Cynk utlenia się, podczas gdy miedź jest zmniejszona.
W drugiej reakcji, z drugiej strony, chlor, bardziej reaktywny element niż jod, wypiera ten ostatni w soli sodu. Tutaj występuje wstecz: najbardziej reaktywny element jest zmniejszony przez utlenianie przemieszanego elementu; Dlatego chlor zmniejsza utlenianie do jodu.
- Tworzenie gazu
W reakcjach można zauważyć, że kilka z nich wygenerowało gazy, a zatem również wchodzą one na ten rodzaj reakcji chemicznej. Podobnie, reakcje z poprzedniej sekcji, przemieszczenie wodoru przez aktywny metal, są uważane za reakcje tworzenia gazu.
Może ci służyć: Dodecil Siarczan sodu (SDS): Struktura, właściwości, zastosowaniaOprócz już wymienionych, siarczki metalowe, na przykład uwalniają siarkowodór (który pachnie jaja zgniły), gdy dodaje się kwas chlorowy:
Na2S (s) + 2HCl (AC) => 2NACL (AC) + H2S (g)
- Metaheza lub podwójne przemieszczenie
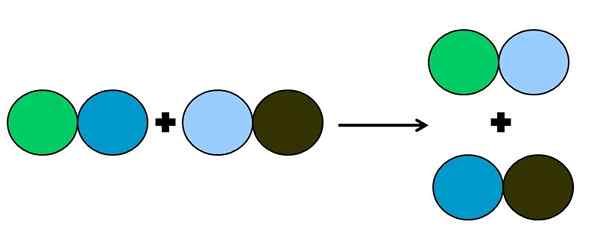 Graficzna reprezentacja reakcji podwójnego przemieszczenia. Źródło: Gabriel Bolívar.
Graficzna reprezentacja reakcji podwójnego przemieszczenia. Źródło: Gabriel Bolívar. W reakcji metatezu lub podwójnego przemieszczenia, to się dzieje, to zmiana par bez transferów elektronów; to znaczy nie jest uważane za reakcję rédox. Jak widać na doskonały obraz, zielone koło łamie łącze z ciemnoniebieskim, aby połączyć się z jasnoniebieskim okręgiem.
Opad atmosferyczny
Gdy interakcje jednej z par są wystarczająco silne, aby przezwyciężyć efekt solverowania płynu, uzyskuje się osad. Poniższe równania chemiczne reprezentują reakcje wytrącania:
Agno3(AC) + NaCl (AC) => Agcl (s) + nano3(AC)
Cacl2(Ac) + na2WSPÓŁ3(ac) => caco3(s) + 2NACL (AC)
W pierwszej reakcji CL- wypiera nie3- Tworząc chlorek srebra, AGCL, który jest białym osadem. A w drugiej reakcji CO32- wypiera CL- Aby wytrącić węglan wapnia.
Kwas podstawowy
Być może najbardziej symbolicznym reakcjami metathanezy jest neutralizacja kwasu zasadowego. Wreszcie, dwie reakcje kwasu podstawowego są pokazane jako przykłady:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Lub (l)
2HCl (AC) + BA (OH)2(Ac) => bacl2(AC) + 2H2Lub (l)
OH- Prowadzą się do CL- Aby utworzyć sole wody i chlorku.
Przykłady reakcji chemicznych
Below and then there will be mention of some chemical reactions with their respective equations and comments.
Przemieszczenie
Zn (S) + Agno3(AC) → 2ag (s) + Zn (no3)2(AC)
Cynk wypiera srebro w soli azotanu: zmniejsza AG+ Ag. W rezultacie metalowe srebro zaczyna wytrącać się na środku, obserwowane na mikroskopie, które drzewa bez srebra. Z drugiej strony azotan łączy się z jonami Zn2+ powodując tworzenie azotanu cynku.
Neutralizacja
Złodziej3(s) + 2HCl (AC) → CACL2(AC) + H2Lub (l) + co2(G)
Kwas solny neutralizuje sól węglanowa wapnia w celu wytworzenia soli, chlorku wapnia, wody i dwutlenku węgla. Co2 bąbelki i jest wykrywane w wodzie. Ten bubb3.
NH3(g) + HCl (g) → NH4Cl (s)
W tej drugiej reakcji opary HCl zneutralizują gazowy amoniak. Chlorek amonu solnego, NH4Cl, jest tworzone jak białawy dym (niższy obraz), ponieważ zawiera bardzo drobne cząstki zawieszone w powietrzu.
 Reakcja treningu chlorku amonu. Źródło: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Reakcja treningu chlorku amonu. Źródło: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Podwójne przemieszczenie
Agno3(AC) + NaCl (AC) → Agcl (s) + nano3(AC)
W reakcji podwójnej przemieszczenia istnieje wymiana „par”. Srebro zmienia parę z sodem. W rezultacie nowa sól, chlorek srebra, AGCL, wytrąca się jak mleczna substancja stała.
Rédox
 W reakcji chemicznej szczekającej ciepła psa, dźwięk i niebieskie światło jest uwalniane. Źródło: Maxim Bilovitskiy przez Wikipedia.
W reakcji chemicznej szczekającej ciepła psa, dźwięk i niebieskie światło jest uwalniane. Źródło: Maxim Bilovitskiy przez Wikipedia. Istnieje niezliczone reakcje rédox. Jednym z najbardziej imponujących jest Barkin Dog:
8 n2Lub (g) + 4 cs2(L) → S8(s) + 4 co2(g) + 8 n2(G)
Uwolniona energia jest tak bardzo, gdy powstają trzy stabilne produkty, że powstał błękitny błysk (obraz doskonały) i ogromny wzrost ciśnienia spowodowany przez gazy (CO2 oraz n2).
Poza tym wszystko towarzyszy bardzo silny dźwięk podobny do szczekania psa. Wytwarzana siarka, s8, Pokryć żółte ściany wewnętrzne rurki.
Który gatunek jest zmniejszony, a który jest utleniony? Zasadniczo elementy mają numer utleniania 0. Dlatego siarka i azot w produktach muszą być gatunkiem, który zyskał lub utracał elektrony.
Siarka utleniona (utracone elektrony), ponieważ miał numer utleniania -2 w CS2 (C4+S22-):
S2- → s0 + 2e-
Podczas gdy azot został zmniejszony (wygrał elektrony), ponieważ miał numer utleniania +1 w n2Lub (n2+ALBO2-):
2n+ + 2E → N0
Rozwiązane ćwiczenia reakcji chemicznych
- Ćwiczenie 1
Co sól wytrąca się w następnej reakcji w podłożu wodnym?
Na2S (ac) + feso4(AC) →?
Zasadniczo wszystkie siarki, z wyjątkiem utworzonych z metali alkalicznych i amonu, wytrąć w środowisku wodnym. Występuje podwójne przemieszczenie: żelazo wiąże się z siarczkiem i sodu z siarczanem:
Na2S (ac) + feso4(AC) → FES (s) + na2południowy zachód4(AC)
- Ćwiczenie 2
Jakie produkty otrzymamy z następującej reakcji?
Pieczęć3)2 + CA (OH)2 →?
Wodorotlenek wapnia nie jest bardzo rozpuszczalny w wodzie; Ale dodanie azotanu miedzi pomaga go rozpuszczyć, ponieważ reaguje on, tworząc odpowiedni wodorotlenek:
Pieczęć3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (nie3)2(AC)
Cu (OH)2 Jest to natychmiast rozpoznawane za to, że jest niebieskim osadem.
- Ćwiczenie 3
Jaka sól wystąpi w następnej reakcji neutralizacji?
AL (OH)3(s) + 3HCl (AC) → ¿¿?
Wodorotlenek glinu zachowuje się jak zasada reagująca z kwasem solnym. W reakcji neutralizacji kwasowo-zasadowej (od Brnsted-Lowry) Woda jest zawsze tworzona, więc drugim produktem musi być chlorek glinowy, ALCL3:
AL (OH)3(s) + 3HCl (AC) → alll3(AC) + 3H2ALBO
Tym razem ALCL3 Nie wytrąca się, ponieważ jest to sól (do pewnego stopnia) rozpuszczalna w wodzie.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Ana Zita. (18 listopada 2019). Reakcje chemiczne. Odzyskane z: Todamatateria.com
- Kashyap Vyas. (23 stycznia 2018 r.). 19 chłodnych reakcji chemicznych, że nauka Prov salcynuje. Odzyskane z: interesujące organy pomiernikowe.com
- Piękna.netto (s.F.). Reakcja. Odzyskane od: BeautifulChemistry.internet
- Wikipedia. (2019). Reakcja chemiczna. Źródło: w:.Wikipedia.org

