Xantoproteic Reaction Foundation, Procedura, Użycie
- 4289
- 859
- Pani Waleria Marek
Reakcja xantoproteic Jest to procedura chemiczna stosowana w celu określenia obecności lub braku aromatycznych aminokwasów, takich jak tyrozyna i tryptofan, które mogą być wolne lub stanowiące rozpuszczalne białka, peptydy lub polipeptydy.
Został również użyty do wykrywania toksycznych substancji na poziomie krwi zawierającej grupę beanceryczną w swojej strukturze. Ten test jest również znany jako reakcja xantoproteiczna Becher.
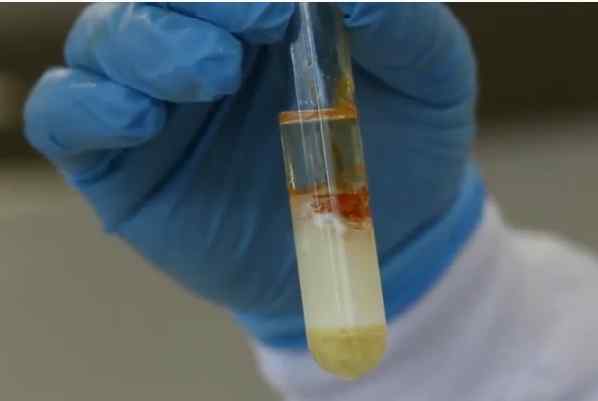
 Pozytywne Xantoproteic Reakcja Źródło: pobrane z wideo: https: // youtu.BE/GZGMBW5W4WO
Pozytywne Xantoproteic Reakcja Źródło: pobrane z wideo: https: // youtu.BE/GZGMBW5W4WO Reakcja xantoproteic wykorzystuje stężony kwas azotowy, ciepło i neutralizujące alkalia. Jeśli podczas neutralizowania reakcji roztwór żółtego do pomarańczowego roztworu jest uważany za pozytywny. Zaobserwowane zabarwienie wynika z tworzenia związków azotowych pochodzących z nitryfikacji grup benzenicznych.
Jeśli chcesz określić ilościowo ilość białek całkowitych, konieczne jest zastosowanie innych metod oznaczania białek, takich jak Biuret.
Reakcja xantoproteic jest stosowana głównie w przypadku analizowania substancji, do której nie jest znany jej skład chemiczny. Zasadniczo reakcja ta jest częścią zestawu testów, które pomogą określić skład chemiczny określonej substancji lub ekstraktu. Dlatego jest szeroko stosowany przez naukowców.
Z drugiej strony reakcja Xantoproteiczna Bechera jest stosowana do wykrywania substancji fenolowych i indolakowych we krwi, możliwe do przewidywania pojawienia się nefropatii, zanim wzrośnie inne kolejne parametry.
[TOC]
Podstawa
Reakcja zasadniczo wykrywa obecność grupy benzenicznej, zarówno w aminokwasach, jak w białkach i peptydach. Kwas azotowy działa na aminokwasowy pierścień benceny, który go posiada, tworzą.
Reakcja wymaga przeprowadzenia ciepła, zwykle powstaje osad, który chmuruje medium, co czyni go mlekiem. Osad może być biały lub żółty. Wreszcie wymaga etapu alkalizacji, który akcentuje kolor. W tym celu stosuje się bazę jako 40% lub wodorotlenek sodu amoniaku.
Reakcja będzie interpretowana jako pozytywna, jeśli podczas ciemnego ogrzewania lub pomarańczowego zaobserwowano silne żółte zabarwienie, alkalizując reakcję. Wykryte aminokwasy to głównie tyrozyna i tryptofan.
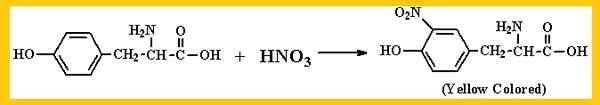 Reakcja xantoproteic. Źródło: http: // esteroisomeras.Blogspot.COM/2013/06/Charakterystyka białek.Html
Reakcja xantoproteic. Źródło: http: // esteroisomeras.Blogspot.COM/2013/06/Charakterystyka białek.Html W przypadku fenyloalaniny, chociaż jest to aromatyczne aminokwasy, rdzeń benzenu tego aminokwasu jest trudny do nitatyzowania w prostej reakcji, dlatego emituje lub negatywnie lub słabo pozytywną reakcję.
Może ci służyć: polarność (chemia): co to jest, definicja, przykładyZasadniczo test xantoproteic można uzupełnić testem Hopkins-Cole, który służy konkretnie identyfikacji triptofanu. Jeśli test xantoproteic jest dodatni, a obecność Hopkins-Cole jest ujemna, obecność tryptofanu jest odrzucana w tym roztworze, co prowadzi do obecności głównie tyrozyny. Podobnie można go również uzupełnić reakcją Millona na wykrywanie tyrozyny, między innymi.
Ta reakcja może być również stosowana w próbkach krwi, w osoczu lub niezmienionej surowicy do diagnozy moczówki lub niewydolności nerek. W tym przypadku poszukiwane jest wykrywanie substancji toksycznych (fenolowych i indolakowych) wytwarzanych z zgnilizny jelitowej.
Substancje te mają grupę benzeniczną, a zatem dają dodatnią reakcję xantoproteic, chociaż substancje reakcyjne nie są ani aminokwasem, ani białkiem.
Procedura
- Reakcja xantoproteic dla wykrywania aminokwasów w grupach aromatycznych
Umieść 1 ml próbki problemowej w czystej i suchej rurce testowej.
-Dodaj 0,5 ml stężonego kwasu azotowego.
-Inkubuj mieszaninę w łazience 70 ° C przez 2 minuty. Wcześniej przygotuj kąpiel Maria w wyżej wymienionej temperaturze.
-Kiedy bierzesz rurkę z kąpieli Maria, można zauważyć, że roztwór stał się mleczny i przyjął żółtawe białe zabarwienie.
-Roztwór jest chłodzony przez upuszczenie zimnej wody u podstawy rurki.
-Przygotowanie jest rzekome przez powoli (upuść przez upuszczenie) 40% roztworu wodorotlenku sodu, dopóki nie nastąpi szok kolorowy.
-Jeśli test jest dodatni, w interfejsie płynnym powstanie ciemnopomarańczowy pierścień.
-Jeśli reakcja jest ujemna, nie będzie tworzenia kolorów.
- Reakcja xantoproteic w celu wykrycia substancji fenolowych i indolakowych we krwi
-Displs 5 cm3 kwasu trichlorooctowego na 20% powyżej 5 cm3 krwi żylnej, osocza lub surowicy, przy czym najbardziej wskazane są. Dobrze wymieszaj i filtruj.
Może ci służyć: kwas azotowy (HNO3)-2 cm3 filtrowania są pobierane i mieszane z 0,5 cm3 kwasu azotowego. Następnie jest podgrzewany do wrzenia, w tym rurce jest umieszczana bezpośrednio na płomieniu zapalniczki przez 30 sekund. Ochładza się wodą i dodaj 1,5 chlorku sodu na 33%.
Jest interpretowany w następujący sposób:
-Wynik negatywny: żółtawy kolor.
-Wynik dodatni (+) cytrynowy żółty.
-(++) Złoty żółty.
-(+++) ciemnożółty do brązu
Można go również interpretować przy użyciu referencyjnej skali kolorymetrycznej Auenrieth, utworzonej przez różne stężenia bicromato potasu. Przygotowuje się to w rozcieńczeniach 10 na 10 z roztworu macierzystego 0,03874%. Każda rurka reprezentuje procent.
Skale interpretacyjne
Istnieją dwie skale interpretacyjne zwane starożytnymi i nowoczesnymi. Wartości normalne to:
Stary stół: od 75 do 85%
Nowoczesny stół: od 15 do 25%
Jeśli kolor probówki znajduje się w środku dwóch wzorów rur, dokonuje się średnia między obiema pomiarami.
Roztwór wzoru dichromianu potasu jest przygotowywany w następujący sposób: 7 mierzy się.9 ml dichromianu potasu w temperaturze 10 N i jest spłukiwanie do 100 ml w Aggorado Ball. W przypadku rozcieńczeń jest przestrzegane, jak pokazano w kolorymetrycznej tabeli Autenrieth.
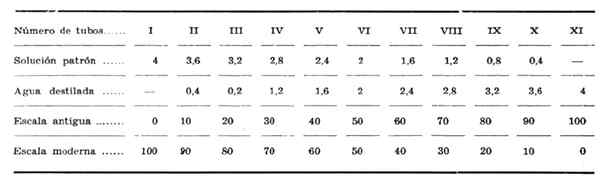 Kolorymetryczny stół autenrieth. Źródło: vásquez a. Reakcja xantoproteic. Hiszpański magazyn kliniczny. 1949; 35 (5): 326-327. Dostępne na: Elsevier
Kolorymetryczny stół autenrieth. Źródło: vásquez a. Reakcja xantoproteic. Hiszpański magazyn kliniczny. 1949; 35 (5): 326-327. Dostępne na: Elsevier Używać
Zastosowanie reakcji xantoproteic jest częścią zestawu testów biochemicznych, które pomagają poznać skład chemiczny nieznanej substancji. Ten test przyczynia się do analizy chemicznej wykrywania białek zawierających grupy benzeniczne w ich strukturze.
Ta reakcja jest szeroko stosowana przez naukowców w różnych badaniach substancji.
W tym sensie Vásquez-Jorge i współpracownicy wykorzystali to i inne reakcje do zbadania zawartości białka w płynach ekstrahowanych z Mangrove Ostion (Crassostrea Rhizophorae).
Podobnie, Rojas i współpracownicy (2009) zastosowali szereg testów, wśród których jest reakcja xantoproteiczna, do analizy glikomakropertydów w osadach Lactozueros de Ricotta.
Z drugiej strony reakcja Xantoproteiczna Bechera została zmodyfikowana przez Volharda do użycia do innych celów. W takim przypadku dla wykrywania substancji fenolowych i indolakowych, które można podnieść znacznie wcześniej (tygodnie lub miesiące), że poziomy mocznika i resztkowego azotu we krwi są zwiększone.
Może ci służyć: cerio: struktura, właściwości, uzyskiwanie, użyciaTe toksyczne odpady powstają z zgnilizny jelitowej żywności.
Substancje te gromadzą się we krwi, gdy nie są odpowiednio wyeliminowane, dlatego pozytywny test xantoproteic może przewidzieć szybkie ustanowienie samego niewydolności nerek lub stanu mocznika.
Według intensywności kolorów możesz ustalić, jak zaawansowane jest. W tym przypadku test jest ilościowy.
U zdrowych ludzi ten test daje lekki żółty kolor, odpowiadający normalnym poziomom tryptofanu i tyrozyny, które mogą znajdować się we krwi.
Podczas gdy u pacjentów z nerkami reakcja xantoproteiczna daje silnie dodatnia ze względu na obecność następujących substancji: fenol, indol, parakresol, aromatyczne kwasy tlenowe,.
Środki ostrożności
Ten test musi zostać wykonany przez przeszkolonych profesjonalistów. Należy wziąć pod uwagę wszystkie standardy biografii, ponieważ stosowane odczynniki to kwasy i zasady żrące.
Jeśli przez przypadek spadnie kilka kropli kwasu azotowego na skórze lub paznokci, stają się żółte, ponieważ obie struktury zawierają białka. Ponadto na skórze i śluzach powoduje poważne oparzenia.
Jeśli nastąpi kontakt ze skórą, protokołem do naśladowania musi być natychmiastowe mycie mydła i wody przez około 20 minut.
Jeśli rozpryskujesz oczy, musisz myć z dużą ilością świeżej wody, starając się otworzyć oczy.
Bibliografia
- „Reakcja xantoproteica” Wikipedia, bezpłatna encyklopedia. 2 września 2019, 17:49 UTC. 21 października 2019, 20:31 Wikipedia.org/
- Vásquez-Jorge i, Guerra-Molina L, Quintana-Tamayo J, Ramírez-Arzuaga J, Fernando-Ballesteros R, Vásquez-Jorge i. Charakterystyka fizykochemiczna i zawartość białka w ekstraktach płynów ostion namorzynowych (Crassostrea Rhizophorae). Chemia kubańska, 2014; 26 (1): 66-74. Dostępne w Redalyc.
- Rojas E, Valbuena E, Torres G, García A, Piñero M, Galindo L. Izolacja i wydajność GMP przez wytrącanie Lactsuero za pomocą kwasu triclorooctowego. Naukowiec. (Maracaibo) 2009; 19 (3): 295-302. Dostępne w: ve.Scielo.
- Vásquez a. Reakcja xantoproteic. Hiszpański magazyn kliniczny. 1949; 35 (5): 326-327. Dostępne na: Elsevier
- Gálvez I, Gárate lub. Reakcje Becher i Andrewesa w chirurgii moczu. Hiszpańska usługa urologii szpitala. Magazyn argentyński Urology 395-404
- « Linki i przykład naziemnego łańcucha pokarmowego
- Charakterystyka i przykłady zjawiska społecznego »

