Odwracalne charakterystyka reakcji i przykłady
- 1198
- 15
- Herbert Wróblewski
A Odwracalna reakcja Jest to, że w pewnym momencie w swoim kursie osiąga stan równowagi, w którym stężenia odczynników i produktów pozostają stałe; to znaczy, że nie różnią się, ponieważ prędkość, z którą jedno jest spożywane, jest taka sama. Mówi się również, że taki stan odpowiada równowagi dynamicznej.
Równowaga można jednak postrzegać jako konsekwencję odwracalności reakcji chemicznej; Ponieważ w nieodwracalnych reakcjach nie można ustalić jakiejkolwiek równowagi. Aby tak się stało, produkty muszą być w stanie reagować na siebie, w określonych warunkach ciśnienia i temperatury, pochodzące z powrót do odczynników.
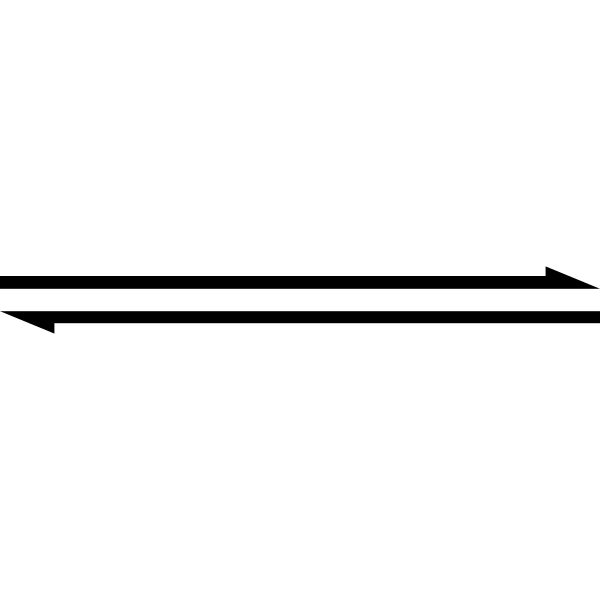
 Symbol podwójnej strzałki wskazuje, że reakcja jest odwracalna. Źródło: Ten obraz SVG został utworzony przez Medium69.Cette Image svg a eté créée par Perium69.Proszę o to: William Crochot [domena publiczna]
Symbol podwójnej strzałki wskazuje, że reakcja jest odwracalna. Źródło: Ten obraz SVG został utworzony przez Medium69.Cette Image svg a eté créée par Perium69.Proszę o to: William Crochot [domena publiczna] Powyższe jest uproszczone przy użyciu symbolu podwójnej strzałki (z dwoma przeciwrów równoległymi). Kiedy widzimy to w równaniu chemicznym, oznacza to, że reakcja przebiega w obu kierunkach: od lewej do prawej (tworzenie produktu) i od prawej do lewej (powstawanie odczynników lub reaktywne).
Mniejszość reakcji chemicznych jest odwracalna i występują bardziej niż wszystkie w syntezie organicznej i nieorganicznej. W tym bardzo ważne jest, aby wiedzieć, jakie warunki sprzyja równowagi w celu oszacowania ilości produktu, które można uzyskać.
[TOC]
Charakterystyka odwracalnych reakcji
Ogólne równanie i równowaga
Odwracalna reakcja ma następujące ogólne równanie, biorąc pod uwagę, że istnieją tylko dwie odczynniki, A i B:
A + B ⇌ C + D
Podwójna strzałka wskazuje, że A i B reagują na wytwarzanie C i D, ale także C i D mogą reagować na siebie, aby zregenerować odczynniki; to znaczy reakcja w przeciwnym kierunku, od prawej do lewej, odbywa się.
Może ci służyć: jaki jest błąd?Bezpośrednia reakcja pochodzą z produktów, podczas gdy odwrotne odczynniki. Jeśli jeden jest egzotermiczny, drugi według logiki musi być endotermiczny i oba występują spontanicznie; Ale niekoniecznie z tą samą prędkością.
Na przykład A i B mogą być mniejsze lub niestabilne niż C i D; I dlatego spożywają szybciej niż C i D mogą je zregenerować.
Jeśli produkty C i D ledwo na siebie reagują, wówczas będzie większa akumulacja produktów niż odczynniki. Oznacza to, że po osiągnięciu równowagi chemicznej będziemy mieli wyższe stężenia C i D niż z A lub B, niezależnie od tego, że ich stężenia się nie różnią.
Mówi się wtedy, że równowaga jest wypierana w lewo, gdzie będzie więcej produktów niż odczynniki.
Zasada Le Châtelier
Odwracalną reakcję charakteryzuje się odbywaniem w obu kierunkach w równaniu chemicznym, osiągając punkt równowagi i reagowanie na zmiany zewnętrzne lub wpływy zgodnie z zasadą Le Châteliera.
W rzeczywistości dzięki tej zasadzie obserwacje Berthollet można wyjaśnić w 1803 roku, kiedy rozpoznał kryształy na2WSPÓŁ3 W Sand Lake położonym w Egipcie. Reakcja podwójnego przemieszczenia byłoby:
Na2WSPÓŁ3(AC) + CACL2(AC) ⇌ NaCl (AC) + CACO3(AC)
Aby nastąpiła odwrotna reakcja, musi istnieć nadmiar NaCl, a zatem równowaga przesunęłaby się w prawo: w kierunku tworzenia Na2WSPÓŁ3.
Ta cecha ma ogromne znaczenie, ponieważ ciśnienia lub temperatury są również manipulowane, aby sprzyjać znaczeniu reakcji generowanej przez gatunek zainteresowania.
Zmiany chemiczne
Zmiany chemiczne odwracalnych reakcji są zwykle mniej widoczne niż zaobserwowane dla nieodwracalnych reakcji. Istnieją jednak reakcje, szczególnie te, w których uczestniczą kompleksy metali, w których widzimy zmiany barwienia zależne od temperatury.
Może ci służyć: Perrin Atomic Model: Charakterystyka, postulujeGatunki chemiczne
Każdy rodzaj związku może być zaangażowany w odwracalną reakcję. Widziano, że dwie sole są w stanie ustalić równowagę, na2WSPÓŁ3 i Cacl2. To samo dzieje się między kompleksami metali lub cząsteczkami. W rzeczywistości znaczna część odwracalnych reakcji wynika z cząsteczek o określonych linkach, które rozbijają się i regenerują raz po raz.
Przykłady odwracalnych reakcji
Rozpuszczanie chlorków kobaltu
Roztwór chlorkowy kobaltu, COCL2, W wodzie plami się różowo, ze względu na powstawanie złożonego ACU. Po podgrzaniu tego rozwiązania kolor zmienia się na niebieski, co daje kolejną odwracalną reakcję:
[Co (h2ALBO)6]2+(AC) (różowy) + 4cl-(AC) + Q ⇌ Cocl42-(AC) (niebieski) + 6H2Lub (l)
Gdzie jest dostarczane ciepło. To ciepło odwadnia kompleks, ale w miarę jak roztwór ochładza się lub w przypadku dodania wody powróci do oryginalnego różowego koloru.
Jodek wodoru
Poniższa odwracalna reakcja jest być może najbardziej klasycznym we wstępie koncepcji równowagi chemicznej:
H2(g) + i2(s) ⇌ 2HI (g)
Zauważ, że reakcję udaje się ustalić równowagę, nawet gdy jod jest w stanie stałym. Wszystkie gatunki są molekularne: H-H, I-I i H-I.
Hydroliza
Hydroliza jest bardzo reprezentatywnymi przykładami reakcji odwracalnych. Wśród najprostszych, z którymi cierpi na skoniugowany kwas lub zasada. Hydroliza jonu amonu, NH4+, i jonu węglanowego, co32-, są następujące:
NH4+(AC) + H2Lub (l) ⇌ nh3(g) + OH-
WSPÓŁ32-(AC) + H2Lub (l) ⇌ HCO3-(AC) + OH-
Jeśli dodamy podstawę, która dostarcza jony oh- Pośrodku, przemieszczamy oba równowagę po lewej stronie.
Może ci służyć: gadolinio: struktura, właściwości, uzyskiwanie, użyciaRozpuszczanie chromianu-Domato
Bardzo podobny jak w pierwszym przykładzie, roztwór chromatu ulega zmianie koloru, ale z powodu zmian temperatury, ale pH. Odwracalna reakcja to:
2cro42-(AC) (żółty) + 2H3ALBO+(Ac) ⇌ cr2ALBO72-(AC) (pomarańczowy) + 3H2Lub (l)
Tak więc, jeśli żółte rozwiązanie CRO42- Jest zakwaszony dowolnym kwasem, jego kolor stanie się natychmiast pomarańczowy. A jeśli jest dodana alkaliczna lub dużo wody, równowaga przesunie się w prawo, ponownie pojawiając się żółty kolor i spożywa2ALBO72-.
Amoniak
Synteza amoniaku, NH3, Obejmuje to odwracalną odwracalną reakcję, tak że reaguje azot gazowy, bardzo obojętny gatunek:
N2(g) + 3H2(s) ⇌ 2nh3(G)
Estryfikacja
I wreszcie wspomniany jest przykład chemii organicznej: estryfikacja. Polega to na uzyskaniu estru z kwasu karboksylowego i alkoholu w silnej kwaśnej pożywce. Odwracalna reakcja to:
Rcooh + r'oh ⇌ rcoor ' + h2ALBO
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja, strona 479-540. MC Graw Hill.
- Wikipedia. (2020). Odwracalna reakcja. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (19 sierpnia 2019). Odwracalna definicja reakcji i egzaminy. Odzyskane z: Thoughtco.com
- Binod Shrestha. (5 czerwca 2019). Odwracalne i nieodwracalne reakcje. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- David Wood. (2020). Odwracalne reakcje chemiczne: definicja i egzaminy. Badanie. Odzyskane z: Study.com
- « Formuła rozwiniętej częściowo, co jest i przykłady (metan, propan, butan ...)
- Nieodwracalne cechy reakcji i przykłady »

