Formuła rozwiniętej częściowo, co jest i przykłady (metan, propan, butan ...)
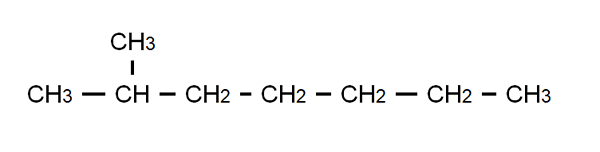
- 4913
- 1031
- Gabriela Łuczak
Formuła rozwiniętej częściowo, Znany również jako formuła półstrukturalna, jest to jedna z wielu możliwych reprezentacji, które można podać do cząsteczki związku. Jest bardzo nawracający w chemii organicznej, szczególnie w tekstach akademickich, ponieważ wraz z nią pokazano prawidłowe uporządkowanie cząsteczki i jej kowalencyjnych wiązań.
W przeciwieństwie do rozwiniętej formuły, która staje się taka sama jak formuła strukturalna, nie pokazuje wiązań C-H, pomijając je w celu uproszczenia reprezentacji. Z tej formuły każdy czytelnik będzie w stanie zrozumieć, czym jest szkielet cząsteczki; Ale nie jego geometria ani żaden ze stereochemicznych aspektów.
 Częściowo rozwinięta formuła 2-metylomeptano. Źródło: Gabriel Bolívar.
Częściowo rozwinięta formuła 2-metylomeptano. Źródło: Gabriel Bolívar. Aby wyjaśnić ten punkt, mamy częściowo rozwiniętą formułę 2-metyloheptano: rozgałęzionego alkanów, którego wzór molekularny jest C8H18, i to jest posłuszne ogólnej wzorze CNH2n+2. Zauważ, że formuła molekularna nie mówi absolutnie nic o strukturze, podczas gdy rozwinięto pół.
Podobnie, zauważ, że wiązania C-H są pomijane, podkreślając tylko wiązania C-C, które tworzą węglany łańcuch lub szkielet. Widać, że w przypadku prostych cząsteczek rozwinięty formuła pokrywa się z skondensowaną formułą; a nawet z molekularnymi.
[TOC]
Przykłady
Metan
Molekularna wzór metanu to Cho4, Cóż, ma cztery łącza C-H i jest geometrią tetrowedralną. Dane te są dostarczane przez formułę strukturalną z klinami na zewnątrz lub poniżej płaszczyzny. W przypadku metanu skondensowana formuła staje się również cho4, Jak opracowane empiryczne i częściowo opracowane. To jedyny związek, dla którego wspomniana jest osobliwość.
Powodem, dla którego częściowo opracowana formuła metanu jest Cho4, Dzieje się tak, ponieważ ich linki C-H nie są pisane; Aby to zrobić, odpowiadałoby formule strukturalnej.
Może ci służyć: solvationPropan
Częściowo opracowana formuła propanu to Cho3-Ch2-Ch3, Posiadanie tylko dwóch linków C-C. Jego cząsteczka jest liniowa, a jeśli pokazuje, jej skondensowana formuła jest dokładnie taka sama: Cho3Ch2Ch3, Z jedyną różnicą, że pominięto linki C-C. W przypadku propanu jest spełnione, że zarówno formuła opracowana, jak i skondensowana pokrywa się.
W rzeczywistości jest to spełnione dla wszystkich alkanów łańcuchów liniowych, ponieważ będzie to nadal widoczne w poniższych sekcjach.
Butan
Formuła butanu na częściowo opracowana jest Cho3-Ch2-Ch2-Ch3. Zauważ, że można go napisać w tej samej linii. Ta formuła ściśle mówiąc, odpowiada formowi N-Butan, wskazując, że jest to liniowy i niezłomny izomer. Rozgałęziony izomer, 2-metylopropan, ma następującą częściowo rozwiniętą formułę:
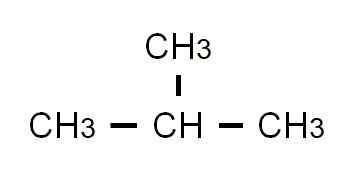 Częściowo rozwinięta formuła 2-metylopropanu. Źródło: Gabriel Bolívar.
Częściowo rozwinięta formuła 2-metylopropanu. Źródło: Gabriel Bolívar. Tym razem nie można go już pisać ani reprezentować w tej samej linii. Te dwa izomery mają ten sam wzór molekularny: C4H10, który nie służy od siebie dyskryminacji.
Pentano
Znowu mamy kolejny alkan: pentan, którego wzór molekularny to c5H12. Częściowo opracowana formuła N-Pentano to rozdz3-Ch2-Ch2-Ch2-Ch3, Łatwe do przedstawienia i interpretacji, bez potrzeby umieszczania linków C-H. Grupy Ch3 Są to, że metyl lub metyl i Choons2 Są metylenem.
Pentan ma inne rozgałęzione izomery strukturalne, które są obserwowane na niższym obrazie reprezentowanym przez ich odpowiednie częściowo opracowane formuły:
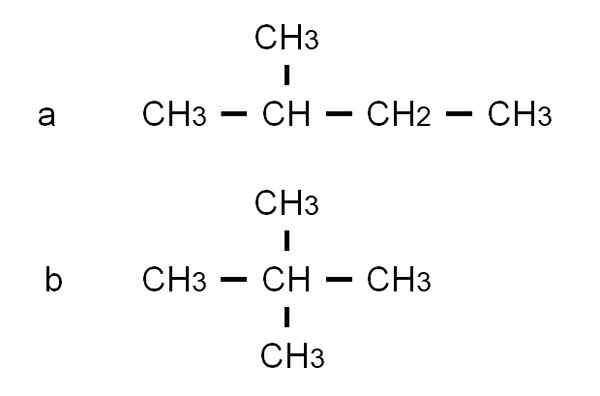 Formuły rozwinięte w części dwóch rozgałęzionych izomerów Pentanu. Źródło: Gabriel Bolívar.
Formuły rozwinięte w części dwóch rozgałęzionych izomerów Pentanu. Źródło: Gabriel Bolívar. Izomer Do Jest to 2-metylobutan, zwany także izopentano. Tymczasem izomer B Jest to 2,2-dimetylopropan, znany również jako neopentano. Jego częściowo opracowane formuły wyjaśniają różnicę między dwoma izomerami; Ale niewiele mówi o tym, jak takie cząsteczki wyglądałyby w kosmosie. Aby to zrobić, wzory strukturalne i modele.
Może ci służyć: kwas sulfonowy: struktura, nomenklatura, właściwości, zastosowaniaEtanol
Formuły rozwinięte w częściowo opracowane są nie tylko stosowane w alkanach, alkenach lub alkinach, ale do każdego rodzaju związku organicznego. Zatem etanol, alkohol ma półpometowaną formułę: CH3-Ch2-Oh. Zauważ, że link C-O jest teraz reprezentowany, ale nie link O-H. Wszystkie wiązania wodorowe są pogardzane.
Liniowe alkohole są łatwe do przedstawienia, podobnie jak alkan. Podsumowując: wszystkie półpomodowe formuły cząsteczek liniowych są łatwe do napisania.
Dimetyloéter
Etyki mogą być również reprezentowane za pomocą formuł opracowanych. W przypadku dimetyloéter, którego wzór molekularny wynosi c2H6Lub, rozwinięte pół3-O-ch3. Zauważ, że dimetyloéter i etanol są izomerami strukturalnymi, ponieważ mają ten sam wzór molekularny (powiedz atomy C, H i O).
Cykloheksan
Formuły rozwinięte w częściowo dla rozgałęzionych związków są bardziej żmudne do reprezentowania niż liniowe; Ale wciąż jest więcej cyklicznych związków, takich jak cykloheksan. Jego wzór molekularny odpowiada mu, jak w przypadku heksen i jego izomerów strukturalnych: C6H12, Ponieważ sześciokątny pierścień liczy się jako nienasycenie.
Aby reprezentować cykloheksan sześciokątny pierścień jest narysowany, na którego wierzchołki będą zlokalizowane grupy metylen2, Tak jak widać poniżej:
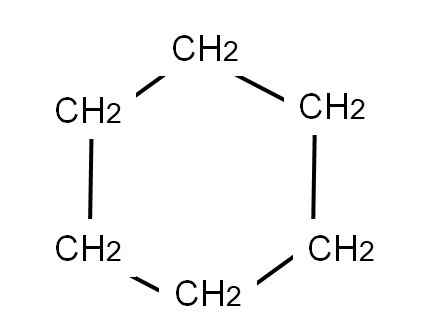 Formuła półproduktywnej cykloheksanu. Źródło: Gabriel Bolívar.
Formuła półproduktywnej cykloheksanu. Źródło: Gabriel Bolívar. Opracowana formuła cykloheksanu wyświetliłaby linki C-H, tak jakby pierścień miał „anteny” telewizji.
Kwas fosforu
Molekularna wzór kwasu fosforu wynosi h3PO3. W przypadku wielu związków nieorganicznych wzór molekularny wystarczy, aby mieć pojęcie o strukturze. Ale istnieje kilka wyjątków, a to jest jeden z nich. Z faktem, że h3PO3 Jest to kwas diprotyczny, półpomieniowana formuła to: HPO (OH)2.
Może ci służyć: neopentil: struktura, cechy, nomenklatura, szkolenieTo znaczy jeden z hydrogenów jest bezpośrednio powiązany z atomem fosforu. Jednak formuła H3PO3 Przyznaje także cząsteczkę z częściowo rozwiniętą formułą: PO (OH)3. Oba są w rzeczywistości to, co znane przez Tautomeres.
Formuły opracowane na półprzestrzeni w chemii nieorganicznej są bardzo podobne do tych skondensowanych w chemii organicznej. W związkach nieorganicznych, za brak wiązań C-H, a za to, że są prostsze, ich wzory molekularne zwykle wystarczają do ich opisania (gdy są związkami kowalencyjnymi).
Ogólny komentarz
Formuły rozwinięte w częściowo opracowane są bardzo powszechne, gdy uczeń uczy się zasad nomenklatury. Ale kiedyś zasymilowane, ogólnie, nuty chemii są zatłoczone szkieletowymi formułami strukturalnymi; To znaczy nie tylko łącza C-H są pomijane, ale także oszczędzają czas podczas ignorowania C.
Przez resztę w chemii organicznej formuły skondensowane są bardziej powtarzające się niż pół -rozwinięte. Oraz w odniesieniu do chemii nieorganicznej, te częściowo rozwinięte formuły są mniej używane.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Formuła rozwiniętej częściowo. Odzyskane z: jest.Wikipedia.org
- Siyavula. (S.F.). Organiczne struktury molekularne. Odzyskane z: siyavula.com
- Jean Kim i Kristina Bonnett. (5 czerwca 2019). Rysowanie struktur organicznych. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Nauczyciele. Marl i Jla. (S.F.). Wprowadzenie do związków węglowych. [PDF]. Źródło: IPN.MX
- « Zrównoważona konsumpcja dla tego, jakie jest zastosowanie, znaczenie, działania, przykłady
- Odwracalne charakterystyka reakcji i przykłady »

