Reakcja endergoniczna
- 1505
- 440
- Paweł Malinowski
 Reakcja endaryczna polega na tym, że nie jest to spontaniczne i wymaga dużo energii
Reakcja endaryczna polega na tym, że nie jest to spontaniczne i wymaga dużo energii Jaka jest reakcja endaryczna?
A Reakcja endergoniczna Jest to taki, który nie jest spontaniczny, a także wymaga wysokiej dostawy energii. W chemii energia ta jest zwykle kaloryczna. Najbardziej znanymi spośród wszystkich reakcji endotermicznych są reakcje endotermiczne, to znaczy te, które pochłaniają ciepło.
Powodem, dla którego nie wszystkie reakcje są spontaniczne, jest to, że spożywają energię, a systemy utworzone przez gatunki obejmują ich entropię. Innymi słowy, dla celów chemicznych stają się one molekularnie bardziej uporządkowane.
Budowanie ceglanej ściany jest przykładem reakcji endowej. Same cegły nie są wystarczająco zwarte, aby utworzyć solidne ciało. Wynika to z faktu, że nie ma wzrostu energii, który promuje jego związek (również odzwierciedlony w możliwych niskich interakcjach międzycząsteczkowych).
Aby zbudować ścianę, potrzebujesz cementu i porodu. Jest to energia, a reakcja nieskierunkowa (ściana nie zostanie zbudowana automatycznie) staje się możliwa, jeśli postrzegana jest korzyść energii (ekonomiczna, w przypadku ściany).
Jeśli nie ma żadnych korzyści, ściana zapadnie się z żadnym zakłóceniami, a ich cegły nigdy nie mogą pozostać zjednoczeni. To samo dotyczy wielu związków chemicznych, których bloki konstrukcyjne nie mogą przyłączyć się spontanicznie.
Charakterystyka reakcji endowej
- To nie jest spontaniczne.
- Pochłaniaj ciepło (lub inny rodzaj energii).
Powodem jest to, że ich produkty mają więcej energii niż odczynniki zaangażowane w reakcję. Powyższe mogą być reprezentowane z następującym równaniem:
ΔG = gProdukty-GOdczynniki
Gdzie gg to zmiana energii wolnej gibbs. Jak gProdukt jest większy (ponieważ jest bardziej energiczny) niż gOdczynniki, Odejmowanie musi być większe niż zero (gg> 0). Poniższy obraz podsumowuje nowo wyjaśnione:
Może ci służyć: siarczan sodu (Na2SO4): struktura, właściwości, stosowanie, uzyskiwanie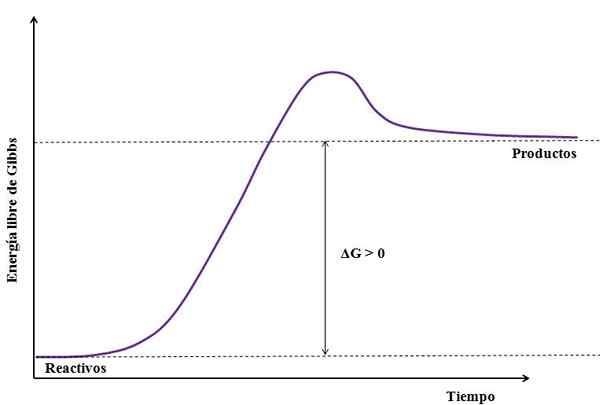 Rysunek reakcji endergonicznej. Źródło: Gabriel Bolívar
Rysunek reakcji endergonicznej. Źródło: Gabriel Bolívar Zwróć uwagę na różnicę między stanami energetycznymi między produktami a odczynnikami (fioletowa linia). Dlatego odczynniki nie przekształcają się w produkty (A+B => C), jeśli najpierw nie ma absorpcji ciepła.
Zwiększ energię swobodną energią
Każda reakcja endergoniczna ma wzrost energii swobodnej systemu systemu. Jeśli w przypadku pewnej reakcji spełni się, że Gg> 0, nie będzie on spontaniczny i będzie wymagał przeprowadzenia zasilania energii.
Jak wiedzieć matematycznie, czy reakcja jest endegoniczna? Stosowanie następującego równania:
ΔG = δH-TΔS
Gdzie ΔH jest entalpią reakcji, to znaczy całkowita energia uwolniona lub wchłonięta, δS jest zmianą entropii, a t temperaturę. Współczynnik TΔS jest utratą energii nie wykorzystywanej w ekspansji lub uporządkowaniu cząsteczek w fazie (stałe, ciekłe lub sodowe).
Zatem ΔG jest energią, którą system może wykorzystać do wykonywania zadania. Ponieważ GG ma dodatni znak dla reakcji endarycznej, należy zastosować energię lub pracę (odczynniki), aby uzyskać produkty.
Znając więc wartości ΔH (dodatnia, dla reakcji endotermicznej i ujemna, dla reakcji egzotermicznej) i TΔS, możesz wiedzieć, czy reakcja jest końcowa -gononiczna.
Oznacza to, że chociaż reakcja jest endotermiczna, NIE To jest koniecznie endogoniczne.
Kostka do lodu
Na przykład kostka lodowa topi się w cieczy pochłaniającej ciepło wody, co pomaga oddzielić jego cząsteczki; Jednak proces jest spontaniczny, a zatem nie jest to reakcja endaryczna.
W przypadku, gdy lód jest założony w temperaturze znacznie poniżej -100 ° C, termin TΔS równania energii swobodnej staje się mały w porównaniu z δH (ponieważ T maleje), a w rezultacie ΔG będzie miało wartość dodatnią.
Może ci służyć: kwas karboksylowyInnymi słowy: stopić lód poniżej -100 ° C jest procesem endegonicznym i nie jest spontaniczny. Podobnym przypadkiem jest zamrażanie wody około 50 ° C, co nie zdarza się spontanicznie.
Linki ich produktów są słabsze
Inną ważną cechą, również związaną z ΔG, jest energia nowych linków. Połączenia utworzonych produktów są słabsze niż łącza odczynników.
Jednak zmniejszenie siły linków jest kompensowane przyrostem masy, co znajduje odzwierciedlenie we właściwościach fizycznych.
Tutaj porównanie z ceglaną ścianą zaczyna tracić znaczenie. Zgodnie z powyższym pręty wewnątrz cegły muszą być silniejsze niż te między nimi a cementem. Jednak ściana jako całość jest bardziej sztywna i odporna na większą masę.
Jest połączony z reakcjami egzergonicznymi
Jeśli reakcje na końcówkę nie są spontaniczne, jak mają miejsce w naturze? Odpowiedź jest spowodowana sprzężeniem z innymi reakcjami, które są dość spontaniczne (exergoniczne) i które w jakiś sposób promują ich rozwój.
Na przykład następujące równanie chemiczne reprezentuje ten punkt:
A + B => C (reakcja endergoniczna)
C + D => e (reakcja egzergoniczna)
Pierwsza reakcja nie jest spontaniczna, więc naturalnie nie mogło się to zdarzyć. Jednak produkcja C pozwala na wystąpienie drugiej reakcji, powodując i.
Dodawanie energii wolnych od Gibbsa dla dwóch reakcji, gg1 i Gg2, Z wynikiem mniejszym niż zero (gg<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Może ci służyć: hydroryGdyby C nie zareagował z D, nigdy nie mógłbym tego utworzyć, ponieważ nie miała odszkodowania energetycznego (jako przypadek pieniędzy ze ścianą z cegły). Mówi się wtedy, że C i D „Jalan” do A i B, aby reakcji, nawet będąc reakcją endegoniczną.
Przykłady reakcji endergonicznych
Fotosynteza
Rośliny wykorzystują energię słoneczną do tworzenia węglowodanów i tlenu z dwutlenku węgla i wody. Co₂ i o2, Małe cząsteczki z mocnymi ogniwami, tworzą cukry, struktur Tarry, które są cięższe, stałe i topią się w temperaturze około 186º C.
Należy zauważyć, że łącza C-C, C-H i C-O są słabsze niż O = C = O i O = O. A z jednostki cukrowej roślina może syntetyzować polisacharydy, takie jak celuloza.
Synteza biomolekuł i makrocząsteczek
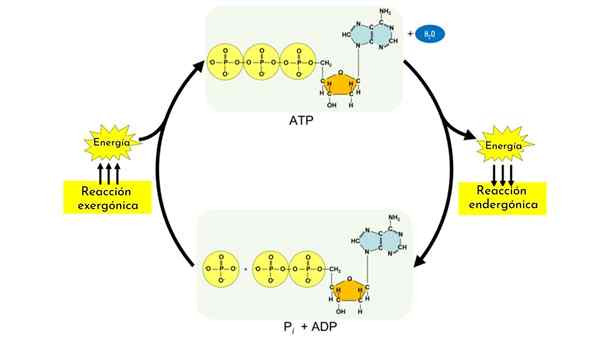
Reakcje endermaniczne są częścią procesów anabolicznych. Podobnie jak węglowodany, inne biomolekuły, takie jak białka i lipidy, wymagają złożonych mechanizmów, które bez nich, i połączone z reakcją hydrolizy ATP, nie mogło być.
Tworzenie diamentów i ciężkich związków ropy
Diamenty wymagają ogromnych ciśnień i temperatur, aby ich składniki mogły zagęścić w krystalicznej substancji stałej.
Jednak niektóre krystalizacje są spontaniczne, chociaż przechodzą z bardzo powolnymi prędkościami (spontaniczność nie jest związana z kinetyką reakcji).
Wreszcie sam olej na ropę reprezentuje produkt reakcji endergonicznych, zwłaszcza ciężkich węglowodorów lub makrocząsteczek zwanych asphaltens.
Ich struktury są bardzo złożone, a ich synteza wymaga dużo czasu (miliony lat), ciepła i działania bakteryjnego.
Inne przykłady
- Komórkowe oddychanie roślin.
- Transport tlenu w krwioobiegu.
- Dyfuzja jonów przez błony komórkowe.
- Skurcz mięśnia.
- Synteza białek komórkowych.
Bibliografia
- Reakcje endermaniczne i egzeeroniczne. Odzyskane z QuimiTube.com
- Darmowa energia. Odzyskane z ES.Khan academy.org
- Definicja reakcji endergonicznej. Pobrano z biologii.internet

