Typy reakcji syntezy, czynniki, przykłady
- 4599
- 518
- Pani Waleria Marek
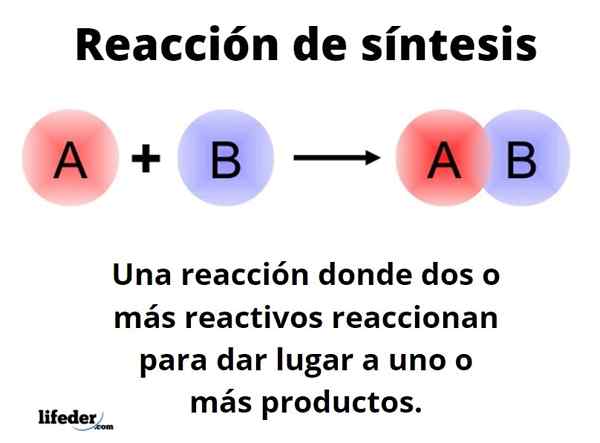
Reakcja syntezy Jest to jeden, w którym reagują dwa lub więcej odczynników, aby móc powstać, ilościowo, jeden lub więcej produktów, na poziomie laboratoryjnym lub przemysłowym. Jest to jedna z najbardziej fundamentalnych reakcji chemii, a jej typy i projekty graniczy z prawie nieskończonością.
Ogólny sposób może być reprezentowany z formularzem: A+B → C. W prostej reakcji syntezy odczynnik do reakcji z innym odczynnikiem B, w celu wytworzenia produktu C. Mówi się, że składa się z jednego kroku. Może się jednak zdarzyć, że najpierw zareagować z E, a następnie F, a wreszcie G (inne odczynniki), aby przekształcić się w produkt C; Oznacza to, że ta sama reakcja ma miejsce w wielu krokach.

Niezależnie od jednego stopnia lub wielu, wszystkie reakcje syntezy oparte są na skuteczności (termodynamika i kinetyka), z którą odczynniki reagują na przekształcenie w produkty, a także wydajność eksperymentalną. Pożądane jest, aby reakcja syntezy przeszła z powodzeniem i wytwarzała jak najwięcej produktów.
[TOC]
Rodzaje reakcji syntezy
Proste lub wielokrotne
Reakcje syntezy nie są zupełnie łatwe do sklasyfikowania. Może to być problem związany z kryteriami chemika. Ponieważ? Załóżmy, że skomentowana powyżej reakcja:
A + E → P1
P1 + F → p2
P2 + G → C
Bycie p1 I p2 pośredniki, które nie są interesujące. Reakcja syntezy produktu lub związku C, zaczynając od głównego odczynnika (ograniczające lub ograniczające odczynnik), jest wielokrotnie lub złożona, ponieważ występuje w kilku etapach, w których uczestniczą inne odczynniki: E, F i G.
Każda z poprzednich trzech reakcji może się składać i rodzaj reakcji chemicznej samej w sobie. Oznacza to, że reakcja syntezy może być dowolnego rodzaju reakcji chemicznych (podwójne przemieszczenie, redoks, spalanie, neutralizacja, nitrowanie, podstawienie itp.), o ile produkt się pochodzi i ma powiązaną wydajność eksperymentalną.
Więc:
A + E → P1
Można to postrzegać jako prostą reakcję syntezy dla produktu p1, niezależnie od rodzaju reakcji. I również:
P1 + F → p2
Jest to kolejna prosta reakcja syntezy dla produktu p2.
Nieorganiczne lub organiczne
Reakcje syntezy mogą być wszelkiego rodzaju pod względem natury reakcji i jej mechanizmu molekularnego. Można je jednak podzielić zgodnie z chemicznym charakterem odczynników i produktów.
Może ci służyć: octan sodu: struktura, właściwości, synteza, zastosowaniaNa przykład, jeśli odczynniki są substancjami nieorganicznymi, mówimy o syntezie nieorganicznej; Gdyby były substancjami organicznymi, rozmawialibyśmy już o syntezie organicznej.
Dziedzina syntezy organicznej jest kolosalna, ponieważ obejmuje produkcje leków, barwników, tworzyw sztucznych, owadobójczych, klejów, perfum, konserwantów, wśród tysięcy innych produktów.
Czynniki zaangażowane w reakcje syntezy
Czynniki zaangażowane w reakcje syntezy to wszystkie te parametry lub zmienne, fizyczne i chemiczne, które bezpośrednio wpływają na wydajność reakcji i jakość produktów powstałych. Niektóre z nich są następującymi:
Temperatura
Temperatura jest niezbędna w każdej reakcji syntezy. W zależności od termodynamiki, może być wygodne, aby pozostać niskim lub wysokim. Podobnie istnieją temperatury, w których prawdopodobne są niepożądane reakcje boczne, więc niezbędne jest ich kontrolowanie i weryfikacja przez cały czas.
Czas
Czas jest również niezbędny w reakcjach syntezy, ponieważ musi zapewnić, że wystarczy, aby zagwarantować ustanowienie równowagi. Po pewnym czasie więcej produktu przestanie uzyskać, i wtedy postanowiono całkowicie zatrzymać syntezę.
Stężenia i jakość odczynników
Im bardziej skoncentrowane są odczynniki, tym szybciej będą reakcje. Należy jednak jasno określić odsetek jego stężeń, a także o jego wielkości, ponieważ minimalna zmiana wpłynie na końcową wydajność.
Z drugiej strony, odczynniki muszą być tak czyste, jak to możliwe, w przeciwnym razie zostaną przyjęte błędne stężenia; Lub gorzej, produkty będą zanieczyszczone lub nastąpi niepożądane reakcje.
Podniecenie
Sposób, w jaki miesza się pożywka reakcyjna, wpłynie na rapides reakcji syntezy.
Ciśnienie
Ciśnienie, podobnie jak stężenie, odgrywa kluczową rolę, szczególnie gdy odczynniki są gatunkami lub substancjami sodowymi. Im większe ciśnienie, tym większe zderzenia lub interakcje między odczynnikami, a zatem będzie bardziej prawdopodobne, że zareaguje.
Ph
PH (kwas lub podstawa) wpływa bezpośrednio na mechanizm reakcji, więc jest to kluczowy czynnik definiowania, które produkty zostaną uzyskane na końcu syntezy.
Może ci służyć: Pojęcie wrzenia: koncepcja, obliczenia i przykładyKatalizatory
Katalizatory to substancje, które przyspieszają reakcje chemiczne, ale bez konsumpcji podczas procesu. Istnieje synteza, która bez twojej interwencji byłaby niemożliwa.
Przykłady reakcji syntezy
Dalej, a na koniec, cytowane zostaną równania chemiczne dla reakcji syntezy kilku związków.
Sól stołowa (chlorek sodu)
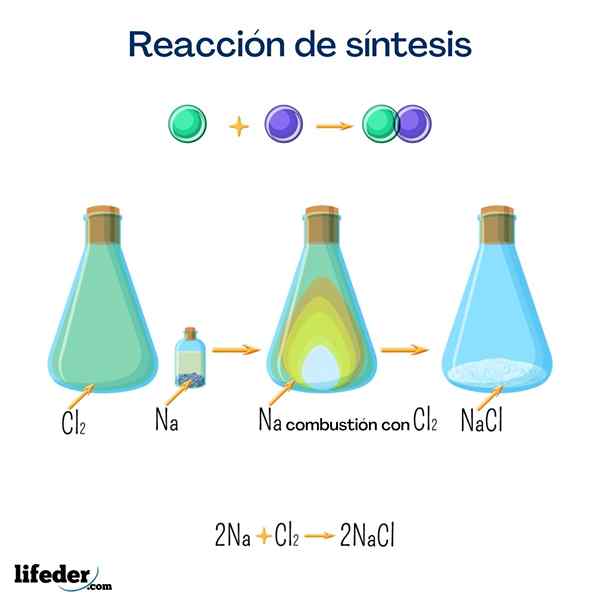
Ta sól jest jedną z najbardziej znanych ze wszystkich z wielkiego użytku domowego. Jest uzyskiwany z sodu i chloru i chociaż można go uzyskać przez następującą reakcję, bardzo łatwo jest go znaleźć naturalnie.
2 Na+Cl 2 → 2 NaClGlukoza
Jest to jedna z najważniejszych reakcji na życie, jaką wiemy. Rośliny wykorzystują dwutlenek węgla i środowisko środowiska ze światłem słonecznym do produkcji glukozy i tlenu.
Reakcję w bardzo ogólny sposób można zobaczyć poniżej, ale ważne jest, aby zrozumieć, że za nią istnieje kilka reakcji i mechanizmów, aby to być możliwe.
6CO2 + 6H2O → C6H12O6 + O2
Sacharoza
Ta reakcja syntezy występuje w żywych organizmach i jest podawana podczas polimeryzacji glukozy z fruktozą. Ze względu na ich strukturę te dwie cząsteczki oddziałują, a końcowym wynikiem są sacharoza i woda, jak widać w następującym równaniu:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Amoniak
3 godz2(g) + n2(g) → 2 NH3(G)
Odczynniki h2 oraz n2 Są gazowe. Ciśnienie musi być wysokie, aby twoje cząsteczki reagowały i pochodzą z amoniaku, NH3. Jest to jedna z najważniejszych reakcji syntezy chemii przemysłowej.
Woda
2 godz2(g) + lub2(g) → 2 h2O (g)
H2 I2 reaguj egzotermicznie, aby wytworzyć pary wodne. Ilość zwolnionej energii jest taka, że wodór jest jedną z najbardziej obiecujących paliw w zastosowaniach lotniczych.
Alkohol
C2H4(g) + h2Lub (l) → CHO3Ch2Och (L)
Etanol jest znany jako alkohol, tylko jeden z wielu istniejących alkoholi. Jego reakcja syntezy polega na nawodnieniu etylenu, C2H4 lub h2C = CH2, gdzie cząsteczka wody jest dodawana do podwójnego wiązania.
Kwas Siarkowy
Kwas siarkowy ma kilka wydajnych tras syntetycznych. Jednak najprostszy składa się z kilku kroków:
Może ci służyć: karboksymetylocelulozaS (s) +o2(g) → SO2(G)
2 Tak2(g)+lub2(g) ⇌ 2 SO3(G)
południowy zachód3(g)+h2Lub (l) → H2południowy zachód4(G)
H2południowy zachód4(g) → h2południowy zachód4(L)
Siarka spala nadmiar tlenu, aby najpierw przekształcić się w SO2, A potem tak3. Wtedy SO3 jest nawodniony w celu wytworzenia oparów H2południowy zachód4, który w końcu skondensuje się w h2południowy zachód4 płyn. Ta synteza jest tak ważna, że samo w sobie wskazuje, jak silny.
Metanol
CO (g) + 2 h2(g) → CH3Och (L)
Gases Co i H2 reaguj i kondensuj na katalizatorach metali, aby spowodować metanol, najprostszy alkohol ze wszystkich.
Siarczan magnezu
Może wystąpić z bardzo prostej reakcji, która składa się z magnezu i kwasu siarkowego. Bardzo trudno jest znaleźć go w naturze bez wody.
Mg + H2SO4 → H2 + MGSO4
Dwutlenek węgla
Dzieje się to naturalnie w kilku procesach, gdy dwutlenek węgla jest wytwarzany z cząsteczką dwutlenku węgla.
Jest obecny w naturalnych procesach, takich jak oddychanie, jako odczynnik w fotosyntezy i występuje łatwo w reakcjach spalania.
C +O2 → CO2
Kwas chlorowodorowy
Kwas solny jest szeroko stosowany jako tani kwas i jako środek reaktywny do syntezy innych związków.
CL2+H2 → 2HCl
Węglan wapnia
Jest powszechnie znany jako bardzo obfity agent z natury, głównie w skałach, minerałach i skorupach w morzu. Jego reakcja opiera się na interakcji tlenku wapnia z dwutlenkiem węgla.
CAO +CO2 → CACO3
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Metler Toledo. (S.F.). Reakcje syntezy. Odzyskany z: MT.com
- Helmestine, Anne Marie, pH.D. (27 sierpnia 2020). Synteza Opis reakcji plus egzaminy. Pobrano z Thoughco.com
- Wikipedia. (2020). Synteza chemiczna. Źródło: w:.Wikipedia.org
- Danielle Reid. (2020). Reakcja syntezy: definicja, wzór i przykład. Badanie. Odzyskane z: Study.com

