Czym jest okresowość chemiczna?
- 1564
- 327
- Filip Augustyn
Okresowość chemiczna Jest to trend lub wzór, który wykazuje elementy chemiczne dla zestawu ich właściwości chemicznych i fizycznych. Staje się rodzajem pokrewieństwa, który był fundamentalnym przewodnikiem dla rodziców chemii w celu organizowania i klasyfikowania wszystkich elementów w dzisiejszym znanym okresowym stole.
118 istniejących elementów (między naturalnymi i sztucznymi) utrzymuje inaczej relacje, które określają je w rodzinach lub grupach. Początkowo pozwoliło to na opisanie reaktywności pierwiastków, a także rodzaju tworzenia się związków; I jeszcze lepiej, przewiduj właściwości tych, którzy jeszcze nie zostały odkryte.
 Elementy stolika okresowego
Elementy stolika okresowego Następnie, podczas gdy XX wieku i fizyka postępowały, właściwości te były skorelowane z strukturą elektroniczną atomu. Zatem elektrony oznaczają okresowość chemiczną w odniesieniu do pierwiastków, ale nie tyle ze względu na ich izotopy i stabilność względną.
Dzięki okresowości chemicznej można zrozumieć, dlaczego pierwiastki są umieszczone w tej samej grupie w tabeli okresowej. Umożliwia także przewidywanie właściwości chemicznych, a nawet fizycznych, wśród elementów różnych mas atomowych.
[TOC]
Wzory i grupy
 Podobnie jak zygzakowani wzorce tych chmur, właściwości elementów wykazują okresową i charakterystyczną tendencję. Źródło: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Podobnie jak zygzakowani wzorce tych chmur, właściwości elementów wykazują okresową i charakterystyczną tendencję. Źródło: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Okresowość chemiczna obserwuje się, zgodnie z oczekiwaniami, w właściwościach okresowych. Charakteryzują się one tendencją ich wartości, ponieważ są one oceniane w okresie okresowym lub grupie.
Zygzak, piłę lub stromą górę można wybrać do celów porównawczych: z wzlotami i upadkami. To znaczy okres okresowy mające minimalne i maksimum dla niektórych elementów. A względne pozycje tych elementów odpowiadają doskonale, z lokalizacją w ich odpowiednich grupach.
Dlatego okresowość chemiczna jest przydatna do analizy go na podstawie grup; Jednak okresy są niezbędne do pełnej wizji trendu.
Może ci służyć: węglan potasowy (K2CO3): struktura, właściwości, użycie, uzyskiwanieBędzie to widoczne z następującymi przykładami okresowości w chemii, która nie tylko zyskuje we właściwościach okresowych, ale także w związkach nieorganicznych i, włączającej, organicznej.
Energia jonizacji
Energia jonizacyjna jest jednym z najwybitniejszych właściwości okresowych. Im większy atom elementu, tym łatwiej będzie usunąć; to znaczy walencji. Dlatego: atomy z małymi radioorami będą miały duże, podczas gdy atomy z dużymi radiotelefonami będą miały małe.
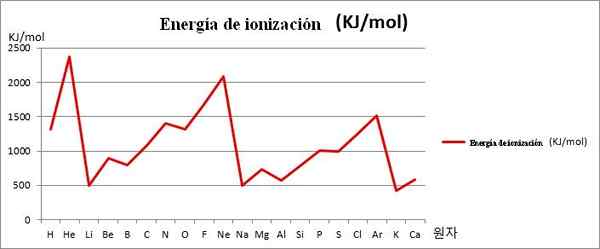 EI vs. grafika. Pierwsze 20 elementów chemicznych. Źródło: Kenneth.JH.HAN/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
EI vs. grafika. Pierwsze 20 elementów chemicznych. Źródło: Kenneth.JH.HAN/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Zwróć uwagę na przykład na powyższym obrazku, że elementy Li, Na i K, mają nieletnich EI, dlatego znajdują się w dolinach lub środkach grafiki. Tymczasem elementy, które, NE i AR, znajdują się na szczytach lub wyższych punktach, ponieważ są bardzo duże w stosunku do innych elementów.
Elementy Li, Na i K należą do grupy metali alkalicznych, charakteryzujących się ich ofiarami EI. Z drugiej strony, elementy, NE i AR odpowiadają gazom szlachetnym, z bardzo wysokim, ponieważ ich atomy są najmniejsze spośród wszystkich elementów dla tego samego okresu stolika okresowego.
Zatem okresowość chemiczna wskazuje, że zmniejsza grupę, ale zwiększa koncertowanie od lewej do prawej.
Blokuj hydros P
Przykład okresowości chemicznej poza okresowymi właściwościami, które widzimy w hydrorach elementów blokowych P.
Na przykład grupa 15 składa się z elementów N, P, AS, SB i BI. Jeśli wiadomo, że amoniak, NH3, Ma azot z liczbą utleniania +3, wówczas można oczekiwać, przez prostą okresowość, że pozostałe elementy mają również podobne hydros. I rzeczywiście jest: NH3, Ph3, Popiół3, SBH3 i Bih3.
Może ci służyć: bor: historia, właściwości, struktura, użyciaKolejny podobny przypadek występuje w grupie 16. Wodnik tlenu to h2Lub woda. Oczekuje się ponownie, że elementy S, SE, TE i PO mają hydrory o równych wzorach, ale z fatalnie różne właściwości. I to jest: h2Cii2SE, h2Te i h2PO. Wynika to z okresowości chemicznej.
Być może najbardziej imponujący przykład jest rozumiany przez węgiel, krzem i hydros germanu. Wodoomienek węgla to Cho4, I Krzemowy, sih4. Germano, przewidywany przez Mendeleva o imieniu Eka-Silicio (ES), musi mieć okresowość wodorotu z wzorem GEH4; Prognozy, które zakończyły się potwierdzeniem po odkryciu i kolejnych badaniach.
Cząsteczki halogenowe
Jeśli wiadomo, że fluorek jest w stanie elementarnym jako cząsteczka M2, Następnie zakłada się, że inne halogeny (Cl, Br, I i At) również tworzą cząsteczki okrzemkowe. A to znaczy jako cząsteczki CL2, Br2 i ja2 Najlepiej znany.
Tlenki i siarki
Podobnie jak wspomniano z hydrorami blokowymi P, Tlenki i siarki dla pierwiastków tej samej grupy wykazują rodzaj korespondencji w odpowiednich formułach chemicznych. Na przykład tlenek litowy to li2Lub będąc tlenkami dla innych metali alkalicznych lub grupy 1: na2DOBRA2Lub RB2O i CS2ALBO.
Dzieje się tak, ponieważ we wszystkich z nich metale z liczbą utleniania +1, oddziałując z anionem lub2-. To samo dzieje się z ich siarkami: Li2S, na2S itp. W przypadku metali alkalicznych lub grupy 2, wzory ich tlenków i siarków są odpowiednio: pszczoły i BES, MGO i MGS, CAO i CAS, SRO i SRS, BAO i BAS.
Może ci służyć: kwas selenarny (H2SO3): właściwości, ryzyko i zastosowaniaTa okresowość dotyczy również (częściowo) tlenków elementów blokowych P: Co2, Sio2, Geo2, B2ALBO3, Do2ALBO3, Ga2ALBO3, itp. Jednak dla elementów blokowych D lub inne bloku P, Ta okresowość staje się bardziej skomplikowana ze względu na najwyższe możliwe liczby utleniania dla tego samego elementu.
Na przykład miedź i srebro należą do grupy 11. Jeden ma dwa tlenki: cuo (cu2+) i Cu2Lub (cu+); Podczas gdy drugi ledwo ma tylko jeden: AG (ag+).
Węglowodory i silany
Zarówno węgiel, jak i krzem mają zdolność do tworzenia odpowiednio wiązań C-C lub SI-SI. Wiązania C-C są znacznie bardziej stabilne, więc struktury węglowodorowe mogą stać.
Wniosek ten wynika ponownie z okresowości chemicznej. Na przykład Ethan, Cho3Ch3 lub c2H6 Disilanum ma swój odpowiednik, sih3tak h3 albo jeśli2H6.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Helmestine, Anne Marie, pH.D. (26 sierpnia 2020). Definicja okołowienia w chemii. Odzyskane z: Thoughtco.com
- I. V. Babaev i Ray Hefferlin. (S.F.). Pojęcie okresowości chemicznej:
Z wzorców hiper-teriodowości Mendeleeva. Odzyskane z: chem.MSU.Ru - Kwiaty p., Theopold k., I Langley r. (S.F.). Okołomia. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Otwarty uniwersytet. (2020). Wzorce chemiczne można znaleźć w tabeli okresowej: okresowość chemiczna. Odzyskane z: otwarte.Edu
- « Koncepcja i przykłady stabilnej równowagi
- Historia socjologii wiejskiej, dziedzina studiów, znaczenie »

