Czym jest kinetyka chemiczna?

- 2664
- 418
- Matylda Duda
Wyjaśniamy, jaka jest kinetyka chemiczna, porządek i szybkość reakcji oraz czynniki wpływające na prędkość
Czym jest kinetyka chemiczna?
Kinetyka chemiczna Jest to gałąź chemii odpowiedzialna za badanie prędkości reakcji chemicznych, jakie czynniki wpływają na tę prędkość i jakie są poszczególne mechanizmy lub kroki, przez które występują reakcje chemiczne.
Ponadto pozwala nam zrozumieć wiele aspektów reakcji chemicznych, takich jak równowaga chemiczna i energia aktywacji, oraz badań procesów katalizy. To ostatnie czyni go szczególnie ważne w wielu aplikacjach, od biochemii po inżynierię przemysłową.
Na środku kinetyki jest prędkość reakcji, którą można zrozumieć jako szybkość, z jaką odczynniki są przekształcane w produkty. Jednak w kinetyce chemicznej istnieje znacznie dokładniejsza definicja.
Definicja prędkości reakcji
Aby podać pełną definicję prędkości reakcji, stosowaną w kinetyce chemicznej, zacznijmy od następującej ogólnej reakcji chemicznej:
W tej reakcji A i B reprezentują odczynniki, C i D reprezentują produkty, podczas gdy A, b, c I D Reprezentują odpowiednie współczynniki stechiometryczne.
Szybkość reakcji (reprezentowana z symbolem v) Wskazuje, jak szybko. Matematycznie, jest to wyrażone w następujący sposób:
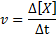
Gdzie δ [x] reprezentuje zmianę stężenia molowego gatunku x (a, b, c lub d) w przedziale czasowym δt.
Oczywiste jest, że im szybciej zostaną spożywane, tym szybciej pozostałe odczynniki zostaną zużyte, a tym szybcie. Z tego powodu konieczne jest tylko zdefiniowanie prędkości w kategoriach jednego z nich.
Może ci służyć: metody rozdziału jednorodnych mieszaninAby upewnić się, że wynik obliczenia prędkości jest zawsze taki sam, niezależnie od tego, który gatunek jest zdefiniowany prędkość, zawsze należy ją podzielić między współczynnik stechiometryczny i umieścić znak mniej przed równaniem, jeśli jest to odczynnik. To jest do powiedzenia:
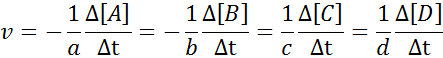
Przykład definicji prędkości reakcji
Biorąc pod uwagę następującą reakcję chemiczną:
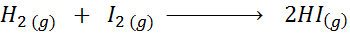
Napisz definicję prędkości reakcji w zależności od każdego zaangażowanego gatunku.
Rozwiązanie:
Pod względem H2:
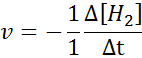
Pod względem i2:
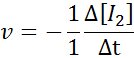
Pod względem cześć:
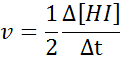
Prawo prędkości i porządek reakcji
Reakcje występują, gdy atomy i cząsteczki zderzają się ze sobą z wystarczającą energią i właściwą orientacją. Prawdopodobieństwo, że to nastąpi, wzrasta, ponieważ atomy i cząsteczki są bardziej skoncentrowane.
Z tego powodu prędkość prawie zawsze zależy od stężenia odczynników. W niektórych przypadkach prędkość zależy również od stężenia któregokolwiek z produktów, a także od stężenia każdego katalizatora lub inhibitora obecnego w środowisku.
Równanie matematyczne, które wiąże prędkość reakcji na stężenie różnych zaangażowanych gatunków, nazywa się ”Prawo prędkości”I w prostszych przypadkach ma następujący formularz:
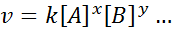
Gdzie k Jest to stała proporcjonalności zwana stała prędkości, a wykładnicy A, B i wszelkich innych gatunków, które pojawiają się w równaniu, są nazywane Zamówienia reakcji.
Zgodnie z sumą wszystkich zamówień reakcji (zwanej globalnym porządkiem), można rozróżnić różne rodzaje reakcji. Różnią się one od tego, jak bardzo stężenie wpływa na prędkość, w wzorze czasu potrzebnym do spożycia połowy odczynników (pół -life) i w sposobie zmienia się stężenie odczynników w czasie (wykresy [a] vs t ).
-
Zamów reakcje 0
Kiedy wszystkie wykładniki w prawie prędkości wynoszą 0, równanie prawa prędkości jest zmniejszone do:
Może ci służyć: skoordynowany link kowalencyjny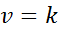
Innymi słowy, są to reakcje występujące przy stałej prędkości i w których prędkość nie zależy od stężenia jakiegokolwiek odczynnika lub produktu.
Zamów wykresy 0
Wykres [a] vs t reakcji rzędu 0 zstępuje linie proste.
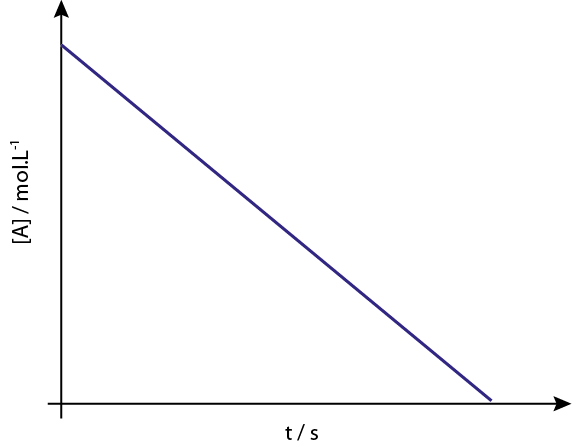
Legenda: wykres stężenia w porównaniu z czasem reakcji rzędu 0 daje linię prostą.
Środkowe życie na zamówienie 0
Dla reakcji rzędu 0, pół -life czas (T1/2) Jest dany przez:
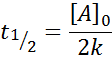
-
Reakcje pierwszego rzędu
W tych reakcjach prędkość zmienia się liniowo wraz ze stężeniem. Prawo prędkości pierwszego rzędu jest:
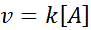
Grafika pierwszego rzędu
Wykres [a] vs t reakcji pierwszego rzędu to opadające hiperbole. Jeśli jednak neperiański logarytm stężenia (LN [a]) vs czas jest wykresem, uzyskano linię prostą.
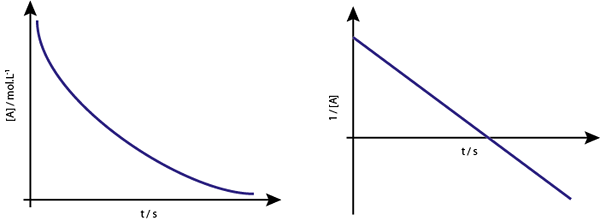 Wykres stężenia w porównaniu z czasem reakcji rzędu 1 daje hiperbolę, ale wykres neperiański logarytm stężenia w porównaniu do czasu daje linię
Wykres stężenia w porównaniu z czasem reakcji rzędu 1 daje hiperbolę, ale wykres neperiański logarytm stężenia w porównaniu do czasu daje linię Życie średnie dla reakcji pierwszego zamówienia
Dla reakcji rzędu 1, T1/2 Nie zależy od początkowego stężenia i jest podana przez:
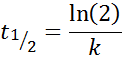
-
Reakcje drugiego rzędu
Reakcja może być drugim rzędem w odniesieniu do jednego odczynnika lub pierwszego rzędu w odniesieniu do dwóch odczynników. W pierwszym przypadku prawo prędkości jest podane przez:
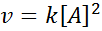
Grafika drugiego rzędu
Wykres [a] vs t reakcji drugiego rzędu to opadające hiperboli. Jeśli jednak wykreślono odwrotność stężenia (1/[a]) vs, uzyskuje się linię prostą.
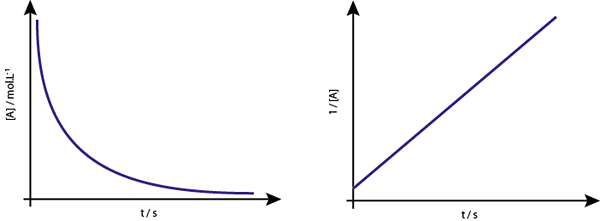 Wykres stężenia vs. czas reakcji rzędu 2 daje krzywą podobną do zstępującej hiperboli, ale wykres stężenia vs. czas daje linię
Wykres stężenia vs. czas reakcji rzędu 2 daje krzywą podobną do zstępującej hiperboli, ale wykres stężenia vs. czas daje linię Życie środkowe dla reakcji drugiego rzędu
Dla reakcji rzędu 2, T1/2 Jest dany przez:
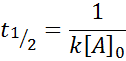
Czynniki, które wpływają na szybkość reakcji
Temperatura
Temperatura zawsze zwiększa prędkość, z jaką występują reakcje, ponieważ częstotliwość i energia, z którymi cząsteczki zderzają się ze sobą. Zależność od prędkości reakcji wraz z temperaturą jest podana przez równanie Arrheniusa.
Może ci służyć: Wodoodpusz: Struktura, właściwości i zastosowaniaCiśnienie
Rosnące ciśnienie jest równoważne zwiększaniu stężenia wszystkich gatunków w pożywce reakcyjnej (dla reakcji fazy gazowej), więc wzrost ciśnienia zwykle zwiększa prędkość reakcji.
Katalizatory
Katalizatory to substancje chemiczne, które są dodawane do pożywki, aby zwiększyć szybkość reakcji. Większość katalizatorów działa poprzez zmianę mechanizmu reakcji według takiego, który wymaga niższej energii aktywacji.
Typowymi przykładami katalizatorów są enzymy w systemach żywych i niektóre metale, takie jak platyna i paladowe.
Inhibitory
Inhibitory są przeciwieństwem katalizatorów. Są substancjami, które czynią reakcje wolniej. Antykorozyjne są przykładami inhibitorów, które mają na celu zmniejszenie prędkości reakcji korozji, aby więcej powierzchni metali bardziej.


