Punkt równoważności

- 2656
- 298
- Paweł Malinowski
 Punktem równoważności jest stężenie wartości stechiometrycznie dodanej
Punktem równoważności jest stężenie wartości stechiometrycznie dodanej Jaki jest punkt równoważności?
On punkt równoważności Jest to, w którym dwie substancje chemiczne zostały całkowicie reagowane. W reakcjach kwasowo-zasadowych punkt ten wskazuje, kiedy zneutralizowano cały kwas lub zasada.
Ta koncepcja jest codziennie w stopniach lub wycenach objętościowych i jest określana przez proste obliczenia matematyczne.
W tym względzie stopień to proces, w którym starannie dodaje się objętość znanego roztworu stężenia, zwanego tytułowym, do nieznanego roztworu stężenia, aby uzyskać jego stężenie.
Zastosowanie wskaźnika pH pozwala poznać moment, w którym kończy się stopień. Wskaźnik jest dodawany do roztworu, który jest zatytułowany do dokonywania kwantyfikacji stężenia, które chcesz poznać.
Wskaźnik kwasowo-zasadowy to związek chemiczny, którego kolor zależy od stężenia wodoru lub pH pożywki.
Zmiana koloru wskaźnika wskazuje punkt końcowy stopnia, chociaż nie punkt równoważności. Idealnie, oba punkty muszą się pokryć, ale w rzeczywistości zmiana koloru może nastąpić kilka kropli po zakończeniu neutralizacji kwasu lub podstawy.
Jaki jest punkt równoważności?
Roztwór nieznanego kwasu stężenia umieszczonego w kolbie.
Wybór wskaźnika musi być dokonany w taki sposób, aby zmienia kolor w punkcie, że reakcja ta sama ilość chemicznych równoważników roztworu i nieznanego roztworu stężenia.
Jest to punkt równoważności, podczas gdy punkt, w którym wskaźnik zmienia kolor, nazywa się punktem końcowym, w którym kończy się tytuł.
Może ci służyć: Rozwiązanie hipotoniczne: składniki, przygotowanie, przykładyPunkt końcowy
Jonizacja lub dysocjacja wskaźnika jest reprezentowana w następujący sposób:
Hin +h₂o w- + H3ALBO+
I dlatego ma stały ka
Ka = [h3ALBO+] [W-] / [Hin]
Związek między wskaźnikiem nieadisowanym (HIN) a wskaźnikiem zdysocjowanym (w-) Określ kolor wskaźnika.
Dodanie kwasu zwiększa stężenie HIN i wytwarza kolor 1 wskaźnika. Tymczasem dodanie podstawy sprzyja wzrostowi stężenia zdysocjowanego wskaźnika (w-) (Kolor 2).
Pożądane jest, aby punkt równoważności pokrył się z punktem końcowym. Aby to zrobić, wybierany jest wskaźnik z przedziałem zmiany koloru, który obejmuje punkt równoważności. Ponadto chodzi o zmniejszenie każdego błędu, który powoduje różnicę między punktem równoważności a punktem końcowym.
Standaryzacja lub ocena rozwiązania jest procesem, w którym określono dokładne stężenie roztworu. Jest to metodologicznie stopień, ale przestrzegana strategia jest inna.
Rozwiązanie pierwotnego standardu jest umieszczane w kolbie, a tytułowe roztwór, który jest znormalizowany, dodaje się za pomocą biurety.
Równoważność miareczkowania silnego kwasu z silną zasadą
100 ml 0,1 M HCl umieszcza się w kolbie i stopniowo dodaje się, za pomocą biurety, roztworu 0,1 M NaOH, określającym zmiany pH roztworu, które powodują kwas wodny.
Początkowo przed dodaniem NaOH pH roztworu HCl wynosi 1.
Dodano silną zasadę (NaOH), a pH stopniowo wzrasta, ale pozostaje kwaśnym pH, ponieważ nadmiar kwasu określa to pH.
Może ci służyć: jodek potasu (KI): struktura, właściwości, uzyskiwanie, użycia, ryzykoJeśli NaOH będzie kontynuowane, jest czas, kiedy punkt równoważności jest osiągnięty, gdzie pH jest neutralne (pH = 7). Kwas zareagował z zasadą konsumpcyjną, ale nie ma jeszcze nadmiaru podstawy.
Dominuje stężenie chlorku sodu, który jest solą neutralną (ani Na+ ani CL- są zhydrolizowane).
Jeśli NaOH będzie kontynuowane, pH nadal rośnie, staje się bardziej podstawowy niż punkt równoważności, ponieważ główny stężenie NaOH dominuje.
Idealnie, zmiana koloru wskaźnika powinna nastąpić do pH = 7, ale ze względu na nagły kształt krzywej tytułowej, można użyć fenoloftaleiny, która zmienia się w jasnoróżowy kolor na pH około 8.
Krzywa stopnia oparta na oparciu o upadku
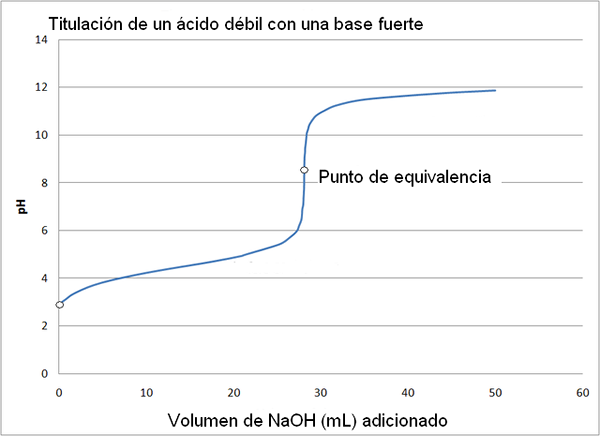 Słaby kwas i silna krzywa miareczkowania zasady. Źródło: Wikimedia Commons
Słaby kwas i silna krzywa miareczkowania zasady. Źródło: Wikimedia Commons Krzywa miareczkowania silnego kwasu o silnej zasadzie jest podobna do krzyżowania górnego obrazu. Jedyną różnicą między obiema krzywymi polega na tym, że pierwsza ma znacznie bardziej nagłą zmianę pH, podczas gdy w krzywej miareczkowania słabego kwasu z silną zasadą można zauważyć, że zmiana jest bardziej stopniowa.
W tym przypadku zatytułowany jest słaby kwas, taki jak kwas octowy (CH3COOH) z silną podstawą, wodorotlenek sodu (NaOH). Reakcja występująca w stopniu może schematyzować następujące:
Naoh +ch3Cooh => ch3Gruchać-Na+ + H₂o
W takim przypadku roztwór buforu octanu powstaje z PKA = 4,74. Uzbrojony region można zobaczyć w niewielkiej i prawie niezauważalnej zmianie przed pH 6.
Może ci służyć: grupa aminowa (NH2): struktura, właściwości, przykładyPunkt równoważności, jak wskazano obraz, wynosi około 8,72, a nie 7. To dlatego, że Cho3Gruchać- Jest to anion, który po hydrolizach generuje OH-, który opiera pH:
Ch3Gruchać- + H₂o ch3Cooh +Oh-
Gradacja
Miareczkowanie kwasu octowego przez wodorotlenek sodu można podzielić na 4 etapy do analizy.
- Przed rozpoczęciem dodawania zasady (NaOH) pH roztworu jest kwaśne i zależy od dysocjacji kwasu octowego.
- W miarę dodawania wodorotlenku sodu tworzenie się roztwór tłumienia octanu, ale w ten sam sposób zwiększa się tworzenie sprzężonej podstawy octanu, co wiąże się ze wzrostem roztworu roztworu roztworu.
- PH punktu równoważności występuje z pH 8,72, który jest szczerze alkaliczny.
Punkt równoważności nie ma stałej wartości i zmienia się w zależności od związków zaangażowanych w stopień.
- Kontynuując dodawanie NaOH, po osiągnięciu punktu równoważności, pH rośnie z powodu nadmiaru wodorotlenku sodu.
Wybór wskaźnika zgodnie z punktem równoważności
Fenoloftaleina jest przydatna w określaniu punktu równoważności w tym stopniu, ponieważ ma swój punkt zwrotny w pH około 8, który wpada w obszar pH miareczkowania kwasu octowego, który obejmuje równoważność punktu (pH = 8,72).
Z drugiej strony, czerwona metylowa nie jest przydatna w określaniu punktu równoważności, ponieważ zmienia kolor w przedziale pH od 4,5 do 6,4.
Bibliografia
- Helmestine, Anne Marie. Definicja punktu równoważności. Wyzdrowiał z Thoughco.com
- Różnica między punktem końcowym a punktem równoważności. Pobrano z różnicy.internet
- Punkt równoważności: definicja i obliczenia. Badanie odzyskało.com

