Włókniste białka
- 4387
- 1349
- Maksymilian Kępa
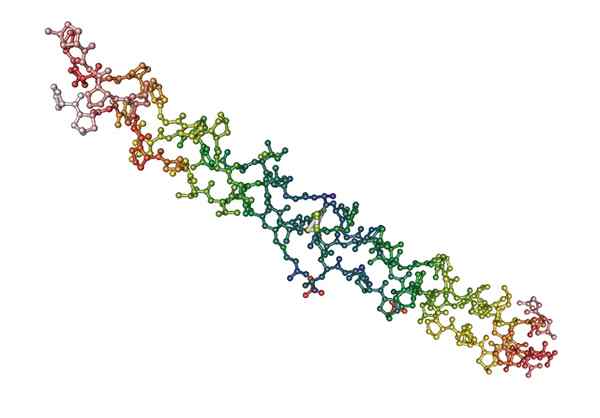
 Struktura molekularna kolagenu, włókniste białko pochodzenia zwierzęcego (źródło: Nevit Dilmen [CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons)
Struktura molekularna kolagenu, włókniste białko pochodzenia zwierzęcego (źródło: Nevit Dilmen [CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons) Jakie są włókniste białka?
włókniste białka, Znane również jako skleoproteiny, są to klasa białek, które są ważną częścią składników strukturalnych dowolnej żywej komórki. Kolagen, elastyna, keratyna lub fibroina są przykładami tego rodzaju białka.
Wypełniają bardzo różnorodne i złożone funkcje. Najważniejsze są ochrona (takie jak ciernie jeżozwierzy) lub wsparcie (takie jak ten, który zapewnia pająki tkaninę, którą tkają i co utrzymuje ich zawieszenie).
Białka włókniste składają się z w pełni rozszerzonych łańcuchów polipeptydowych, które są zorganizowane, tworząc rodzaj „błonnika” lub „liny” o wielkiej oporności. Białka te są mechanicznie bardzo silne i są nierozpuszczalne w wodzie.
W przeważającej części składniki białek włóknistych to kolejno powtarzane polimery aminokwasowe.
Ludzkość próbowała.
Struktura
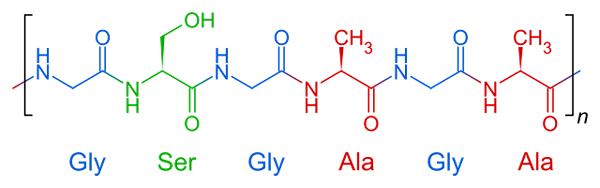 Powtarzalna struktura jedwabnej fibroiny, włóknistego białka
Powtarzalna struktura jedwabnej fibroiny, włóknistego białka Białka włókniste mają stosunkowo prosty skład w swojej strukturze. Są one ogólnie tworzone przez trzy lub cztery zjednoczone aminokwasy między.
Oznacza to, że jeśli białko składa się z aminokwasów, takich jak lizyna, arginina i tryptofan, następujący aminokwas, który dołączy do tryptofanu, będzie znów lizyna, a następnie arginina i inna cząsteczka tryptofanu i tak dalej.
Istnieją białka włókniskowe, które mają motywy aminokwasowe rozmieszczone przez dwa lub trzy aminokwasy różne od powtarzających się motywów ich sekwencji, aw innych białkach sekwencja aminokwasowa może być bardzo zmienna, 10 lub 15 różnych aminokwasów.
Może ci służyć: OvuliparosStruktury wielu włóknistych białek zostały scharakteryzowane za pomocą technik krystalografii X -GRAY i metodami jądrowej rezonansu magnetycznego. Dzięki temu białko z włóknem, rurkowatymi, laminarnymi, spiralnymi, „lejkami” itp.
Każdy polipeptyd powtarzających się motywów unikalny tworzy włókno, a każdy włókno jest jednostką setek jednostek, które tworzą ultrastrukturę „białka włóknistego”. Ogólnie rzecz biorąc, każdy filament jest dostępny w sposób spiralny w odniesieniu do innych.
Funkcje
Ze względu na sieć światłowodową tworzącą białka włókniste, ich główne funkcje polegają na służbie jako wsparcie strukturalne, oporność i materiał ochrony dla tkanek różnych żywych organizmów.
Struktury ochrony złożone z włóknistych białek mogą chronić istotne narządy przed kręgowcami przed ciosami mechanicznymi, niekorzystnymi warunkami klimatycznymi lub drapieżnym atakiem.
Poziom specjalizacji białek włóknistych jest wyjątkowy w królestwie zwierząt. Na przykład Spider Web jest niezbędną tkaniną wsparcia dla sposobu życia, który noszą pająki. Ten materiał ma unikalny opór i elastyczność.

Tak bardzo, że obecnie wiele materiałów syntetycznych próbuje odtworzyć elastyczność i opór Spider Web, nawet przy użyciu organizmów transgenicznych do syntezy tego materiału za pomocą narzędzi biotechnologicznych. Należy jednak zauważyć, że oczekiwany sukces nie został jeszcze uzyskany.
Ważną właściwością, jaką mają białka włókniste, jest to, że pozwalają one na połączenie między różnymi tkankami zwierząt kręgowców.
Może ci służyć: oksydorredyktazy: cechy, struktura, funkcje, przykładyPonadto wszechstronne właściwości tych białek pozwalają żywych organizmach tworzyć materiały łączące oporność i elastyczność. W wielu przypadkach to tworzy podstawowe elementy ruchu mięśni u kręgowców.
Przykłady białek włóknistych
Kolagen
Jest to białko pochodzenia zwierzęcego i być może jedno z najliczniejszych w ciele zwierząt kręgowców, ponieważ większość tkanek łącznych komponuje. Kolagen wyróżnia się swoimi silnymi, rozszerzalnymi, nierozpuszczalnymi i chemicznie obojętnymi właściwościami.
Komponuje - głównie - do skóry, rogówki, dysków międzykręgowych, ścięgien i naczyń krwionośnych. Włókno kolagenowe składa się z potrójnego równoległego śmigła, który jest prawie w jej trzeciej części, tylko glicynę aminokwasową.
Białko to tworzy struktury znane jako „mikrofibryle kolagenowe”, które składają się ze połączenia kilku potrójnych śmigieł kolagenu.
Elastyna
 Elastyny koni konia. Źródło: Marta S. C. Godinho, Chavaunne t. Thorpe, Steve E. Greenwald i Hazel r. C. Ekran, CC BY-SA 4.0, Via Wikimedia Commons
Elastyny koni konia. Źródło: Marta S. C. Godinho, Chavaunne t. Thorpe, Steve E. Greenwald i Hazel r. C. Ekran, CC BY-SA 4.0, Via Wikimedia Commons Podobnie jak kolagen, elastyna jest białkiem, które jest częścią tkanki łącznej. Jednak w przeciwieństwie do pierwszego, zapewnia elastyczność tkankom, zamiast oporu.
Włókna elastyny składają się z aminokwasów waliny, proliny i glicyny. Te aminokwasy mają wysoce hydrofobowe cechy i ustalono, że elastyczność tego włóknistego białka jest spowodowana interakcjami elektrostatycznymi w jego strukturze.
Elastyna jest obfita w tkankach, które są intensywnie poddawane cyklom rozszerzającym i relaksującym. W kręgowcach znajduje się w tętnicach, więzadłach, płucach i skórze.
Keratyna
 Keratyna. Źródło: Maksim, CC BY-SA 3.0, Via Wikimedia Commons
Keratyna. Źródło: Maksim, CC BY-SA 3.0, Via Wikimedia Commons Keratyna jest białkiem, które znajduje się głównie w ektodermalnej warstwie zwierząt kręgowców. To białko tworzy ważne struktury, jako włosy, paznokcie, ciernie, pióra, rogi,.
Może ci służyć: flora i fauna lasu tropikalnegoKeratyna może składać się z α-kweratyny lub β-cheratyny. Α-kweratyna jest znacznie bardziej sztywna niż β-cheatina. Wynika to z faktu, że keratyna-α składa się z śmigieł α, które są bogate w aminokwas cysteinowy, który ma zdolność tworzenia mostów disiarczkowych z innymi równymi aminokwasami.
Z drugiej strony w β-to jest ono składane w większym odsetku aminokwasów polarnych i apolowych, które mogą tworzyć mosty wodorowe i organizować się w złożonych arkuszach β. Oznacza to, że jego struktura jest mniej odporna.
Fibroina
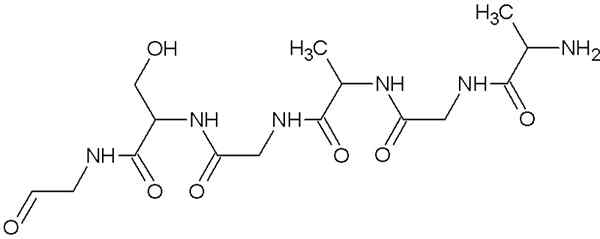 Struktura molekularna fibroiny
Struktura molekularna fibroiny Jest to białko, które komponuje pająk i pasma wytwarzane przez jedwabne robaki. Te wątki składają się głównie z aminokwasów glicyny, seryny i alaniny.
Struktury tych białek to arkusze β zorganizowane antyrównoległości do orientacji włókna. Ta cecha nadaje mu odporność, elastyczność i niewielką pojemność okręgową.
Fibroine nie jest bardzo rozpuszczalna w wodzie i jest winna jej wielkiej elastyczności wielkiej sztywności, że połączenie aminokwasów w swojej pierwotnej strukturze i mosty Vander Waals, które powstają między grupami wtórnymi aminokwasów.

