Właściwości fizyczne i chemiczne wody

- 2362
- 737
- Pani Waleria Marek
właściwości fizyczne i chemiczne wody Są to wszystkie objawy wody, które możemy zmierzyć dzięki interakcjom ich cząsteczek ze sobą lub ich środowiskiem. Ale czym jest woda? Woda jest substancją lub cząsteczką chemiczną, która powstaje przez połączenie atomu tlenu (O) z dwoma atomami wodoru (H).
Te trzy atomy pozostają zjednoczone przez tworzenie kowalencyjnych więzi, bardzo silne i stabilne powiązania. Cząsteczka wody służy do wzoru H2Lub możliwość pisania jako H-O-H. Jest to ta cząsteczka, jej linki i interakcje są odpowiedzialne za bycie bezbarwną i bez smaku substancją płynną.

Woda jest w dużej rozłożonej proporcji na ziemi, między świeżą i osoloną wodą. Woda jest niezbędna do istnienia na naszej planecie, ponieważ jest to bardzo cenne zasoby naturalne. Wynosi od 60 do 70% w organizmach żywych, co jest wysokim odsetkiem, który pozwala im wypełnić niezliczone funkcje.
Wśród niektórych z tych ważnych funkcji są strukturalne, regulatory, takie jak utrzymanie temperatury ciała i regulacja pH (kwasowość lub zasadowość) w granicach normalnych. Podobnie woda wykonuje transport składników odżywczych i odpadów w żywych istotach.
Jest również stosowany w wielu obszarach produktywnej, technologicznej, naukowej i codziennej rutynowej pracy człowieka; Od toalety, gotowania jedzenia, między innymi.
[TOC]
Fizyczne właściwości wody
Fizyczne właściwości wody są związane z cechami lub wielkościami, które można zmierzyć lub określić, rozważając materię, takie jak jej masa, energia, między innymi.
Wśród fizycznych wielkości wody są jego kolor, zapach, sposób, w jaki można go znaleźć, oraz wszystkie te, które możemy określić bez reakcji lub zmienić jego skład chemiczny.
Smak
Smakując czystą wodę do naszego podniebienia, okazuje się, że jest ona niewidoczna lub bez smaku. Jest równie bezwonny lub zapach. W procesie oczyszczania można postrzegać niewielki zapach, które są spowodowane pozostałościami chloru. To minerały dają wodę różne litery smaków.
Aspekt

Woda ogólnie jest bezbarwna i przezroczysta, gdy jest obserwowana w szklance. Wydaje się jednak, że miał jasnoniebieski kolor, gdy gromadził się w dużych ilościach w dużych pojemnikach lub obserwowany w lodowcach, rzekach lub morzach.
Może ci służyć: jakie są źródła badań?I w rzeczywistości woda wykazuje pewne blade niebieskawe zabarwienie, którego postrzeganie jest skoncentrowane, im wyższa ilość wody.
Stany wodne
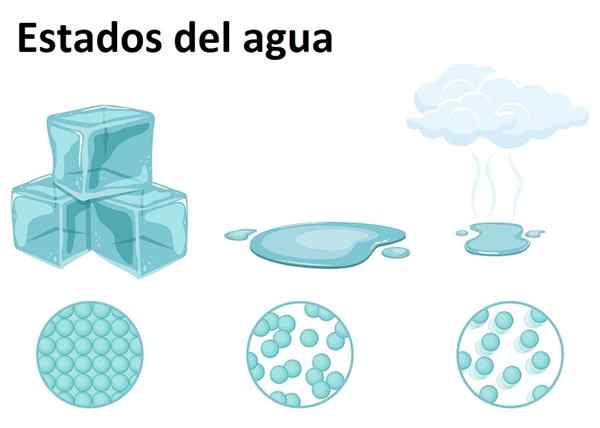 Stan stały, ciekł i gazowy
Stan stały, ciekł i gazowy Woda jest bardzo obfita na ziemi i można ją znaleźć w dowolnym z trzech stanów materii: stały, ciekł lub gazowy. Woda w temperaturze pokojowej jest substancją ciekłą, która odpowiada jej najczęstszej postaci.
Jako stała, woda nazywa się lodem lub śniegiem, w zależności od wielkości jego kryształów i procesu jej powstawania. Tymczasem stan gazowy powstaje, gdy woda przechodzi ze stanu płynnego do gazu, tworząc słynną parę wodną, łatwo rozpoznawalną w kuchni i powyżej jedzenia.
Gęstość
Zakresy gęstości czystej wody około 1 g/cm3. Tymczasem gęstość wody morskiej jest nieco wyższa z powodu zawartej soli.
Punkt zamarzania
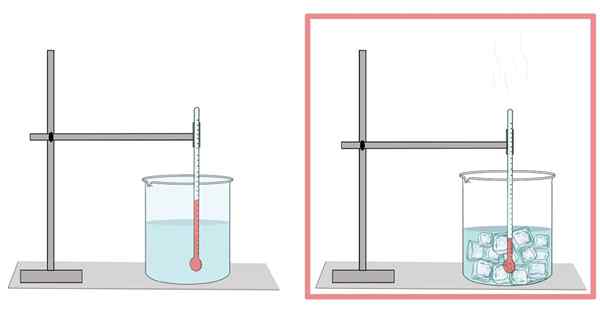
Woda zamarza w temperaturze 0 ° C. W tej temperaturze przechodzi z fazy ciekłej do ciała stałego. Kiedy woda jest zamrożona, rozszerza się. Dlatego w swojej stałej postaci ma mniejszą gęstość niż w stanie ciekłym, co ułatwia lód na płynnej wodzie.
Podobnie jest to powód, dla którego chłodzenie wody w butelce nie powinno być dużo wypełniane, ponieważ lód się rozszerza i kończy łamanie butelki.
Punkt wrzenia
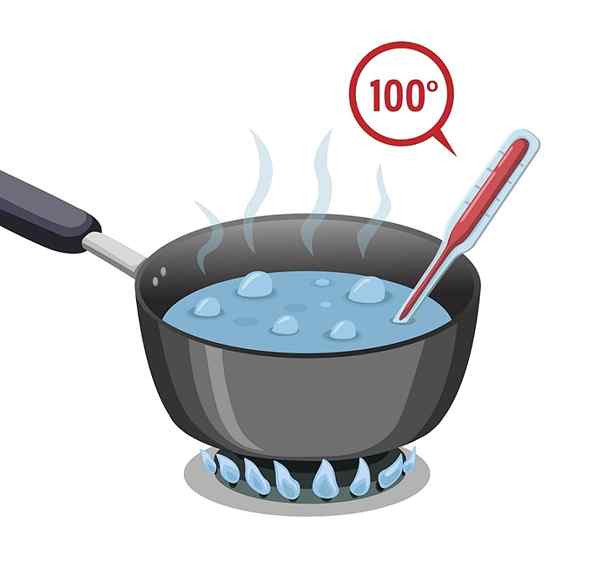
Woda ma wysoką temperaturę wrzenia, która wynosi 100 ° C. Musi być poddany gorąco, aby mógł się ogrzewać i gotować lub osiągnąć temperaturę wrzenia.
Woda ma następnie wysokie ciepło właściwe lub nazywane pojemnością cieplną, co powoduje, że opóźnia ogrzewanie; Ale także ostygnięcie, to znaczy proces wymagany do utraty nabyty ciepło jest powolny.
Ta właściwość sprawia, że jest bardzo przydatna w systemach chłodzenia, w systemach regulacji temperatury ciała, między innymi powiązanymi.
Przewodność elektryczna
Woda jest dobrym przewodnikiem elektrycznym. Jednak woda zawsze będzie miała pewną ilość jonów, co daje mu właściwość posiadania jednego z najwyższych stałych dielektrycznych wśród niekometalicznych cieczy.
Spójność
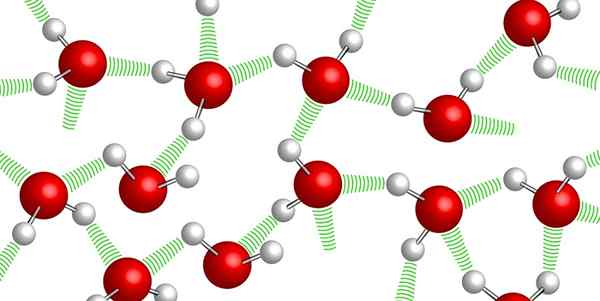 Mosty wodorowe między cząsteczkami wody
Mosty wodorowe między cząsteczkami wody Cząsteczki wody pozostają razem ze sobą dzięki SO -Caled Mosty Wodorowe: słabe wiązania ustalone między jedną a drugą cząsteczką wody. Z powodu tego wysokiego poziomu spójności bardzo trudno jest sprężyć wodę.
Może ci służyć: 7 instrumentów badawczych dokumentalnychPrzystąpienie

Woda łatwo przylegać na przykład do dobrze czystej powierzchni szklanki, tworząc folia, którą nazywamy wilgocią lub „mokrą”. Ponadto woda szybko przylega do naszej skóry, więc zmoczymy, gdy tylko dostaniemy się do basenu. W przeciwnym razie wyschlibyśmy w kilka sekund.
Napięcie powierzchniowe
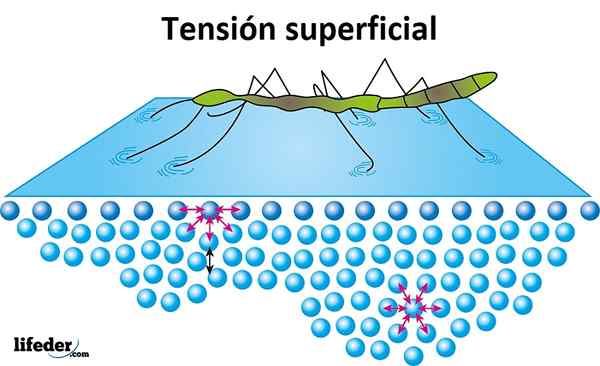
Napięcie powierzchniowe to odporność oferowana przez ciecz na jej powierzchni do penetrowania. Woda ma wysokie napięcie powierzchniowe, produkt spójności, który istnieje między jej cząsteczkami, co sprawia, że łatwo się tworzy, zamiast swobodnego rozkładania gładkiej powierzchni.
Napięcie powierzchniowe jest dowodowe, gdy owady wydają się poruszać lub chodzić po wodzie bez tonięcia, i jest to powód, dla którego niektóre liście lub inne lekkie obiekty mogą unosić się nad wodą.
Kapilarność

Łatwość, z jaką woda unosi się lub nisko przez rurkę kapilarną, opisuje właściwość kapilarności wody. Ta właściwość wynika również z wysokich właściwości spójności i przyczepności, jaką ma woda.
Kapilaryzacja jest wykorzystywana przez natura rośliny, aby dostarczyć wodę do liści najwyższych gałęzi drzewa, a także ułatwia jej wchłanianie przez korzenie roślin.
Podobnie właściwości napięcia powierzchniowego i kapilarności sprawiają, że woda jest strukturalną częścią komórek, która jest częścią krwi, która łatwo przebiega lub przepływa przez różne naczynia krwionośne.
Działanie rozpuszczalnika

Woda może rozpuścić wiele substancji, co jest niezbędne dla żywych organizmów, ponieważ wszystkie reakcje chemiczne żywych istot występują w środowisku wodnym. W organizmach żywych służy jako transport składników odżywczych, jonów i wielu innych substancji.
Służy również do transportu odpadów, takich jak mocznik, który jest eliminowany w wodzie moczu. Kiedy substancja rozpuszcza się i dobrze miesza z wodą, mówi się, że jest hydrofilowa lub hydrosolubna. Jeśli nie mieszasz ani nie rozpuszczasz, mówi się, że substancja jest hydrofobowa lub nierozpuszczalna w wodzie.
Właściwości wody chemicznej
Właściwości chemiczne lub cechy to te, które występują, gdy powstają zmiany w strukturze chemicznej wody. Ważne jest zatem krótkie spojrzenie na jego strukturę molekularną.
Natura chemiczna
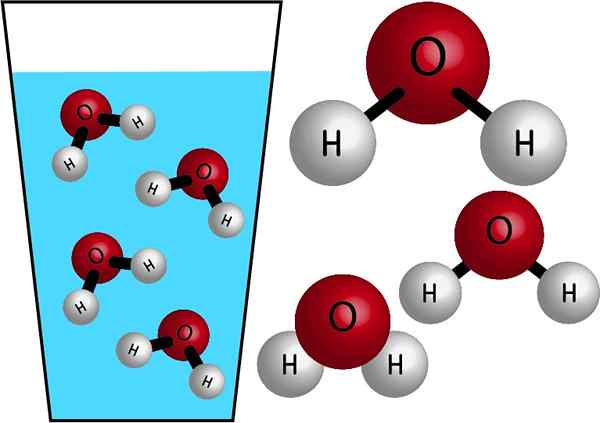
Woda jest cząsteczką nieorganiczną, ponieważ nie zawiera C (węgiel), a jej wzór chemiczny wynosi h2ALBO. Do ich atomów łączy się dzieleniem elektronów tworzących wiązania kowalencyjne, silne i bardzo stabilne łącza. Jego masa trzonowa wynosi 18 g/mol, to znaczy jeden kret wody ma masę 18 gramów.
Może ci służyć: badania naukoweBiegunowość
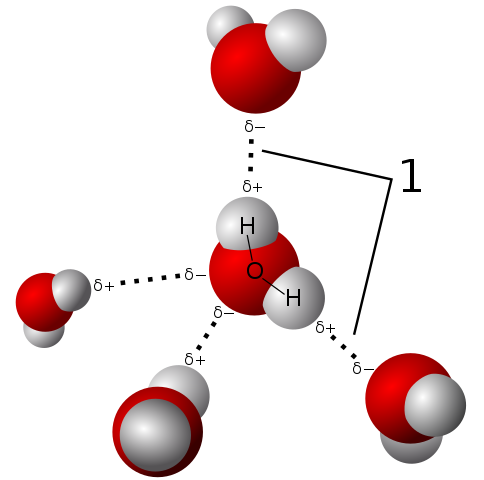 Polaryzacja wody pozwala jej cząsteczce na ustanowienie bardzo silnych mostów wodorowych
Polaryzacja wody pozwala jej cząsteczce na ustanowienie bardzo silnych mostów wodorowych Cząsteczka wody jest neutralna, ale przedstawia pewną polaryzację, ponieważ dzielenie się jej elektronami nie jest tak sprawiedliwe.
Ponieważ tlen silniej przyciąga wspólne elektron, cząsteczka wody znajduje się z tą stroną, w której tlen ma tendencję do pewnego obciążenia ujemnego; I dlatego pozostaje z dodatnim obciążeniem częściowym, w którym są hydrogeny (obserwuj górny obraz).
Ta polaryzacja ułatwia zjednoczenie cząsteczek wody i Związek Wody z innymi cząsteczkami, które również mają różnice obciążenia w ich strukturze, co promuje właściwości fizyczne opisane w poprzednich sekcjach.
Jonizacja
Spontanicznie w ciekłej wodzie występuje niewielka jonizacja lub samozocjacja. Oznacza to, że niektóre z jego cząsteczek są reorganizowane poprzez zmianę normalnej struktury molekularnej generując nowe elektrycznie obciążone cząsteczki, takie jak jony hydronowe (H (H. H3ALBO+) i hydroksyl (OH-).
Pojemność reaktywna
Woda reaguje z wieloma substancjami, tworząc wielką różnorodność związków chemicznych. Przez elektrolizę woda można złamać poprzez oddzielenie tlenu od dwóch hydrogenów. Proces ten występuje, gdy prąd elektryczny przechodzi przez wodę. Nawet woda w postaci stałej może być również częścią niektórych reakcji chemicznych.
Ph
 PH blisko 7
PH blisko 7 Czysta woda ma neutralne pH (równe 7), podczas gdy woda morska jest lekko alkaliczna (większa niż 7). Woda deszczowa jest nieznacznie zakwaszona (pH mniejsza niż 7) po zmieszaniu z składnikami występującymi w atmosferze, takim jak dwutlenek węgla lub CO2, Na przykład.
Anfoteryzm
Woda jest amfotanem, to znaczy może zachowywać się jak kwas lub jako podstawa w zależności od pH roztworu. Ta właściwość chemiczna obsługuje swoją rolę jako regulator pH.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Castillero m. ALBO. (2020). Psychologia i umysł. 15 właściwości fizycznych i chemicznych wody. Odzyskane z: psychologii i.com
- Wikipedia (2020). Właściwości wody. Źródło: w:.Wikipedia.org
- Ostre k. DO. (S.F.). Woda: struktura i właściwości. Odzyskane z: Crystal.Med.Upenn.Edu
- Byju's. (S.F.). Właściwości fizyczne i chemiczne wody. Odzyskane z: Byjus.com
- Energia i środowisko szkolne. (S.F.). Woda była zasobem. Odzyskane z: Eariscuola.internet

