Charakterystyka procesu politycznego, zastosowania i przykłady

- 1960
- 129
- Matylda Duda
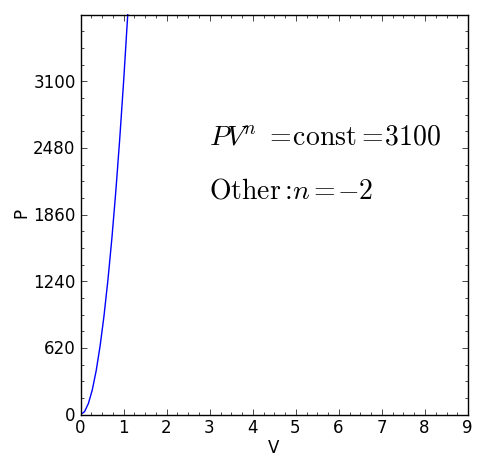
A Proces polityczny Jest to proces termodynamiczny, który występuje, gdy związek między ciśnieniem P i objętość V podane przez P.VN Pozostaje stały. Wykładnik N Jest to liczba rzeczywista, ogólnie między zero a nieskończonością, ale w niektórych przypadkach może być ujemne.
Wartość N otrzymać nazwę Indeks polityczny I należy podkreślić, że podczas politropowego procesu termodynamicznego powiedział, że indeks musi zachować stałą wartość, w przeciwnym razie proces nie będzie uważany za politropowy.
 Rysunek 1. Charakterystyczne równanie politropowego procesu termodynamicznego. Źródło: f. Zapata.
Rysunek 1. Charakterystyczne równanie politropowego procesu termodynamicznego. Źródło: f. Zapata. [TOC]
Charakterystyka procesów politropowych
Niektóre charakterystyczne przypadki procesów politropowych to:
- Proces izotermiczny (w stałej temperaturze t), w którym wykładnik wynosi n = 1.
- Proces izobaryczny (stałe ciśnienie p), w tym przypadku n = 0.
- Proces izokoryczny (do stałej objętości V), dla którego n =+∞.
- Procesy adiabatyczne (do stałej entropii), w których wykładnik wynosi n = γ, będąc γ stałą adiabatyczną. Ta stała jest ilorazem między pojemnością cieplną przy stałym ciśnieniu CP podzielonym przez pojemność cieplną przy stałej objętości CV:
γ = CP/CV
- Każdy inny proces termodynamiczny, który nie jest żadnym z poprzednich przypadków. Ale przestrzegaj P.VN = CTTE Z prawdziwym i stałym indeksem politropowym N Będzie to również proces politropowy.
 Rysunek 2. Różne charakterystyczne przypadki politropowych procesów termodynamicznych. Źródło: Wikimedia Commons.
Rysunek 2. Różne charakterystyczne przypadki politropowych procesów termodynamicznych. Źródło: Wikimedia Commons. Aplikacje
Jednym z głównych zastosowań równania politropowego jest obliczenie pracy wykonanej przez zamknięty układ termodynamiczny, gdy przechodzi on ze stanu początkowego do innego końca w sposób quasi -statyczny, to znaczy po sukcesji stanów równowagi.
Praca w procesach politropowych dla różnych wartości n
Dla n ≠ 1
Prace mechaniczne W przeprowadzone przez zamknięty układ termodynamiczny jest obliczany na podstawie wyrażenia:
W = ∫p.DV
Może ci służyć: diamagnetyzm: materiały, aplikacje, przykładyGdzie p jest ciśnieniem i v objętość.
Podobnie jak w przypadku procesu politropowego, związek między ciśnieniem a objętością wynosi:
P.V N = stała = c
Oczyszczanie P poprzedniego wyrażenia, aby zastąpić go w wyrażeniu pracy:
P = c /V N
Masz pracę mechaniczną podczas procesu politropowego, który rozpoczyna się w stanie początkowym 1, a kończy w stanie końcowym 2. Wszystko to pojawia się w następującym wyrażeniu:

\left&space;[V_2^1-n-V_1^1-n&space;\right&space;])
C = p1 V1N = P2 V2N
Zastępowanie wartości stały w ekspresji pracy jest uzyskiwane:
W = (p2 V2 - P1 V1)/(1-N)
W przypadku, gdy substancja robocza można modelować jako gaz idealny, ma następujące równanie stanu:
P.V = m.R.T
Gdzie m jest liczbą moli idealnego gazu, a r jest uniwersalną stałą gazów.
Dla idealnego gazu, który następuje po politropowym z indeksem politropii inną od urządzenia i który przechodzi ze stanu o początkowej temperaturze t1 do innego stanu o temperaturze t2 Prace wykonane jest następujący formuła:
W = m r (t2 - T1)/(1-N)
Dla n → ∞
Zgodnie z wzorem dla prac uzyskanych w poprzednim rozdziale praca politropowego z n = ∞ jest zerowa, ponieważ ekspresja pracy jest podzielona między nieskończoność, a zatem wynik ma tendencję do zera.
Innym sposobem osiągnięcia tego wyniku jest rozpoczęcie od relacji P1 V1N = P2 V2N, które można przepisać w następujący sposób:
(P1/P2) = (V2/V1)N
Biorąc korzeń n-Thicker w każdym otrzymanym członku:
(V2/V1) = (p1/P2)(1/n)
W przypadku n → ∞, musisz (v2/V1) = 1, co oznacza, że:
Może ci służyć: Ceded Heat: Formule, jak je obliczyć i rozwiązane ćwiczeniaV2 = V1
Oznacza to, że objętość nie zmienia się w procesie politropowym z n → ∞. Dlatego różnica objętości DV w całce pracy mechanicznej wynosi 0. Tego rodzaju procesy politropowe są również znane jako procesy izokoryczny, o Procesy przy stałej objętości.
Dla n = 1
Znowu mamy wyraz pracy:
W = ∫p DV
W przypadku procesu politropowego o n = 1 związek między ciśnieniem a objętością wynosi:
P V = stała = C
Oczyszczając P poprzedniego wyrażenia i zastępując, wykonano pracę, aby przejść ze stanu początkowego 1 do stanu końcowego 2:

To jest do powiedzenia:
W = c ln (v2/V1).
Ponieważ stany początkowe i końcowe są dobrze ustalone, podobnie jak CTTE. To jest do powiedzenia:
C = p1 V1 = P2 V2
Wreszcie, dostępne są następujące przydatne wyrażenia, aby znaleźć pracę mechaniczną politropowego zamkniętego układu, w którym n = 1.
W = p1 V1 LN (v2/V1) = P2 V2 LN (v2/V1)
Jeśli składa się substancja robocza M Mole idealnego gazu, wówczas można zastosować równanie gazowe idealne: p v = m.R.T.
W tym przypadku, jak P.V1 = CTTE, proces politropowy o n = 1 jest procesem w stałej temperaturze t (izotermicznej), dzięki czemu można uzyskać następujące wyrażenia pracy:
W = m r t1 LN (v2/V1) = m r t2 LN (v2/V1)
 Rysunek 3. Topnienie Carambana, przykład procesu izotermicznego. Źródło: Pixabay.
Rysunek 3. Topnienie Carambana, przykład procesu izotermicznego. Źródło: Pixabay. Przykłady procesów politropowych
- Przykład 1
Załóżmy cylinder z ruchomym tłokiem pełnym z kilogramem powietrza. Początkowo powietrze zajmuje tom v1= 0,2 m3 pod ciśnieniem p1= 400 kPa. Proces politropowy następuje n = γ = 1,4, którego stan końcowy ma ciśnienie p2 = 100 kPa. Określić pracę wykonaną w powietrzu na tłoku.
Rozwiązanie
Gdy wskaźnik politropii jest równy stałej adiabatycznej, istnieje proces, w którym substancja robocza (powietrze) nie wymienia ciepła z środowiskiem, a zatem nie zmienia entropii.
Może ci służyć: trzecie prawo termodynamiki: wzory, równania, przykładyW przypadku powietrza idealnego gazu diatomic masz:
γ = CP/CV, z CP = (7/2) R i CV = (5/2) R
Więc:
γ = 7/5 = 1,4
Korzystając z wyrażenia procesu politropowego, można określić końcową objętość powietrza:
V2 = [Str2 V11.4)/P2](1/1.4) = 0,54 m3.
Teraz istnieją warunki do zastosowania wzoru roboczego wykonanego w procesie politropowym dla n ≠ 1 uzyskane powyżej:
W = (p2 V2 - P1 V1)/(1-N)
Zastąpienie odpowiednich wartości to:
W = (100 kPa 0,54 m3 - 400 kPa 0,2 m3)/(1 - 1,4) = 65,4 kJ
- Przykład 2
Załóż ten sam cylinder z przykładu 1, z ruchomym tłokiem pełnym z kilogramem powietrza. Początkowo powietrze zajmuje objętość V1 = 0,2 m3 Pod ciśnieniem P1 = 400 kPa. Ale w przeciwieństwie do poprzedniego przypadku powietrze rozszerza się izotermicznie, aby osiągnąć ciśnienie końcowe P2 = 100 kPa. Określić pracę wykonaną w powietrzu na tłoku.
Rozwiązanie
Jak wcześniej widać, procesy izotermiczne są procesami politropowymi o indeksie n = 1, więc jest spełnione, że:
P1 V1 = P2 V2
W ten sposób ostateczny objętość można łatwo odłączyć, aby uzyskać:
V2 = 0,8 m3
Następnie użycie wyrażenia pracy wcześniej uzyskanej dla przypadku n = 1 musisz pracować w powietrzu na tłoku w tym procesie:
W = P1 V1 LN (V2/V1) = 400000 PA × 0,2 M3 LN (0,8/0,2) = 110,9 kJ.
Bibliografia
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill.
- Cengel i. 2012. Termodynamika. 7. edycja. McGraw Hill.
- Figueroa, zm. (2005). Seria: Fizyka nauk i inżynierii. Tom 4. Płyny i termodynamika. Pod redakcją Douglas Figueroa (USB).
- López, c. Pierwsze prawo termodynamiki. Odzyskane z: cultureacientafica.com.
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Serway, r., Vulle, c. 2011. Podstawy fizyki. 9na ed. Cengage Learning.
- Uniwersytet Sevilla. Maszyny termiczne. Odzyskany z: Laplace.nas.Jest.
- Wikiwand. Proces polityczny. Odzyskane z: Wikiwand.com.
- « Badanie badań, co jest, typy i przykłady
- Rozgraniczenie tematu badawczego, co składa się i przykłady »

