Struktura chemiczna Pencanona, właściwości, synteza,
- 3520
- 109
- Matylda Duda
Pentanona Jest to związek organiczny, należący do rodziny ketonów, którego wzór chemiczny to C5H10ALBO. Pozostaje jednym z najprostszych ketonów i składa się z bezbarwnej cieczy o aromatie podobnym do aromatu acetonu. Od niego odtąd, w odniesieniu do liczby węgla ich szkieletu, ketony obecne izomer pozycji.
Podczas mówienia o położeniu izomerii odnosi się do tego, gdzie jest grupa karbonylowa, C = O. Zatem Puntanona w rzeczywistości składa się z dwóch związków o właściwościach fizycznych, które różnią się ledwo od siebie: 2-penon i 3-penone (niższy obraz). Oba są płynne, ale ich temperatury wrzenia są takie same, więc nie można ich oddzielić destylacją.
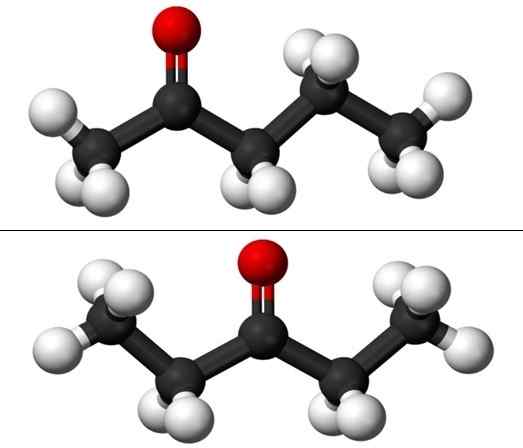
 Cząsteczki izomerów pozycji dla Pentanony. Źródło: Jynto i Ben Mills przez Wikipedia.
Cząsteczki izomerów pozycji dla Pentanony. Źródło: Jynto i Ben Mills przez Wikipedia. Jednak każdy z dwóch pentanonów ma własną drogę syntezy, więc jest mało prawdopodobne, aby istniała ich mieszanka; mieszanka, która może być możliwa do oddzielania przez zamrażanie.
Jego zastosowania są ograniczone, szczególnie jako rozpuszczalniki organiczne; Alternatywy dla acetonu w mediach, w których pracujesz z temperaturą wyższą niż jej niską temperaturę wrzenia. Są to również materiały początkowe do innej syntezy organicznej, ponieważ ich grupa C = O może zmniejszyć lub cierpieć dodanie nukleofilowe.
[TOC]
Struktura chemiczna
Pozycjonowanie izomerów
Na obrazie mamy struktury molekularne dwóch izomerów pozycji dla Puntanona, reprezentowane przez model sfer i prętów. Czarne kule odpowiadają szkieletom gazowanym, atomom białym do wodoru i czerwonym atomom tlenu w grupie C = O.
2-pintanone
2-Ponanona (powyżej) ma grupę C = lub w drugim węglu, co jest równoważne, jeśli był w pokoju; to znaczy 2-ponanona i 4-pantanona są równoważne, ponieważ wystarczy obrócić je o 180º.
Może ci służyć: tetrachlor węglowy (CCL4)Po lewej stronie C = O masz rodnik metylowy, Cho3-, A po jego prawej radykalnej propile. Dlatego ta Cetona otrzymuje również nazwę (mniej używana) od Metil Propil Cetona (MPK w języku angielskim). Możesz zobaczyć asymetrię tej struktury na pierwszy rzut oka.
3-penone
3-péntanona (poniżej) ma grupę C = O w trzecim węglu. Zauważ, że ten izomer jest większą wersją acetonu i że jest również bardzo symetryczny; Dwa rodniki po bokach grupy C = O są takie same: dwa rodniki etylowe, CH3Ch2-. Właśnie dlatego 3-Pananona nazywa się także Cetona Diestil (lub aceton dimetylo).
Interakcje międzycząsteczkowe
Obecność grupy karbonylowej, zarówno w 2-pantanonie, jak i w 3-penonie, nadaje polarności cząsteczce.
Dlatego oba izomery Pentanona są w stanie wchodzić w interakcje ze sobą przez dipol-dipol.
Podobnie, londyńskie siły dyspersji między węglem a uwodoranymi szkieletami interweniują w mniejszym stopniu.
Posiadając Puntanona, większy obszar cząsteczkowy i masa w porównaniu do acetonu, ten udział ten zwiększa moment dipolowy i pozwala na wyższą temperaturę wrzenia (102 ° C> 56 ºC). W rzeczywistości dwa izomery odparowują się w temperaturze 102 ° C; podczas gdy zamarzają w różnych temperaturach.
Kryształy
Prawdopodobnie w krystalizacji symetrie odgrywają ważną rolę. Na przykład punkt fuzji 2 -pantanona wynosi -78 ° C, podczas gdy 3 -péntanona, -39 ºC.
Może ci służyć: prawo AvogadroOznacza to, że kryształy 3-Pantanona są bardziej stabilne w stosunku do temperatury; Jego cząsteczki są bardziej spójne i wymagają więcej ciepła, aby się rozdzielić w fazie ciekłej.
Gdyby istniała mieszanka obu izomerów, 3-penon byłby pierwszym, który krystalizowałby, w końcu będąc 2-Pananona w niższej temperaturze. Cząsteczki 3-pantanonu, bardziej symetryczne, są zorientowane łatwiej niż cząsteczki 2-ponanona: asymetryczne i jednocześnie bardziej dynamiczne.
Nieruchomości
Wygląd fizyczny
Bezbarwne ciecze o aromatach podobnym do aromatu acetonu.
Masa cząsteczkowa
86,13 g/mol
Gęstość
0,81 g/ml (3-ponanona)
0,809 g/ml (2-Ponanona)
Temperatura topnienia
-78 ° C (2-Ponanona)
-39 ° C (3-Ponanona)
Punkt wrzenia
102 ° C (dla obu izomerów)
Rozpuszczalność wody
35 g/l (3-ponenona)
60 g/l (2-Ponenona)
Ciśnienie pary
35 mmHg (3-Ponenona)
270 mmHg (2-pantanonu) w temperaturze 20 ° C
Wartości te nie są przydatne do bezpośredniego porównania ciśnienia pary obu izomerów, ponieważ pierwsza jest zgłaszana bez temperatury, w której została zmierzona.
Punkt flash
12,78 ° C (3-Ponanona)
10 ° C (2-Ponanona)
Stabilność
Dwa izomery Pentanona są wyjątkowo łatwopalne, więc muszą pozostać tak daleko od dowolnego źródła ciepła. Punkty flash wskazują, że płomień może ustawić opary obu pentanów, nawet w temperaturze 10 ° C.
Synteza
Chociaż dwa izomery Pentanona są fizycznie i chemicznie bardzo podobne, ich syntetyczne drogi są niezależne od drugiego, więc jest mało prawdopodobne, aby oba uzyskano w tej samej syntezy.
2-pintanone
Począwszy od odczynnika 2-penolowego, alkoholu wtórnego, można to utlenić do 2 ponanonu za pomocą kwasu hipochlornego utworzonego in situ, HCLO, jako środka utleniającego. Utlenianie byłoby:
Może ci służyć: bez elektrolitów: cechy i przykłady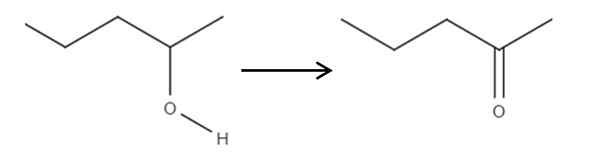 Utlenianie 2-pantanolu w 2-Pantanona. Źródło: Gabriel Bolívar.
Utlenianie 2-pantanolu w 2-Pantanona. Źródło: Gabriel Bolívar. Po prostu łącze C-OH staje się c = o. Istnieją inne metody syntezy 2-penona, ale jest to najprostsze do zrozumienia.
3-penone
3-pintanon można zsyntetyzować za pomocą środków3Ch2Cooh. Ta syntetyczna trasa wytwarza symetryczne ketony i jest to cząsteczka cho3Cooh straci grupę Cooh w postaci CO2, Podczas gdy druga twoja grupa oh w postaci h2ALBO:
2ch3Ch2Cooh => ch3Ch2Coch2Ch3 + WSPÓŁ2 + H2ALBO
Kolejną nieco bardziej złożoną drogą jest bezpośrednio reakcja mieszanki etylenu, Cho2= Ch2, WSPÓŁ2 i H2 Aby utworzyć 3-ponanona.
Aplikacje
O ile aplikacja nie jest bardzo rygorystyczna, jest to specyficzna synteza lub że wykazano również, że dwa izomery nie powodują tych samych wyników, nie ma znaczenia między użyciem 2-penonu lub 3-penonu w żadnym z jego zastosowania.
To znaczy „nie ma znaczenia”, jeśli chcesz użyć 2-Ponanona lub 3-penona jako rozpuszczalnika obrazów lub żywic lub jako nieszczęśliwych, ponieważ najważniejsze kryteria będą jego ceną i dostępnością. 3-penon jest wykorzystywany w branży motoryzacyjnej do badania zachowania gazów wewnątrz silników spalania wewnętrznego.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Wikipedia. (2019). 3-pain. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). 2-pontenone. Baza danych Pubchem. CID = 7895. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Royal Society of Chemistry. (2019). 3-pain. Odzyskany z: Chemspider.com
- Profesor t. Nalli. (2013). Utlenianie 2-pintanolu i destylacja produktu. Odzyskane z: kurs1.Winona.Edu

