Cząstki subatomiczne
- 4292
- 1061
- Arkady Sawicki
 Główne cząstki subatomowe
Główne cząstki subatomowe Co to są cząstki subatomowe?
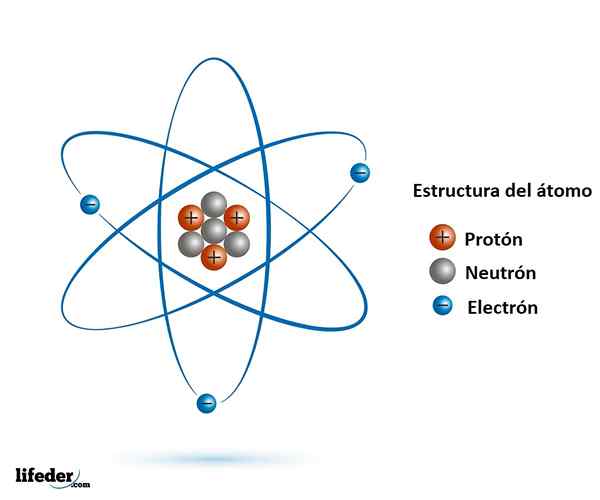
Cząstki subatomiczne Są mniejsze niż atom i znajdują się w naturze, prawie wszystkie są jego częścią. Znamy dobrze główne i najbardziej stabilne, które są elektronem, protonem i neutronem.
Cała materia składa się z tych cząstek, chociaż są inne, chociaż przez długi czas jej istnienie było zignorowane. Pierwsze modele atomowe, pochodzące z kilku stuleci przed Chrystusem, zakładały, że atomy były niepodzielne, coś takiego jak kulki, które w pewnym sensie połączyły się różne elementy.
Kiedy dowiedziała się, że tak nie było, dzięki odkryciom elektronu w XIX wieku i jądro atomowym na początku XX wieku, naukowcy zastanawiali się, czy te cząstki mają wewnętrzną strukturę.
Okazało się, że zarówno proton, jak i neutron to cząstki złożone z jeszcze mniejszych, które nie mają wewnętrznej struktury: są to cząsteczki elementarne.
Dlatego cząstki subatomowe są podzielone na:
- Cząstki złożone.
- Cząstki elementarne.
Cząstki elementarne to kwarki, gluony i leptonie. Kwarki i gluony tworzą protony i neutrony, podczas gdy elektron, cząstka elementarna, jest Lepton.
Odkrycie cząstek subatomowych
Odkrycia cząstek subatomowych rozpoczęły się od dziewiętnastego wieku, a pierwszym znalezionym był elektron.
W 1890 r. Fizycy byli bardzo zajęci badaniem promieniowania i transmisji fal elektromagnetycznych. J. J. Thomson był jednym z nich i przeprowadził liczne eksperymenty z rurką, do której powietrze zostało wyodrębnione i umieszczone na kilku elektrodach.
 J. J. Thomson
J. J. Thomson Kiedy zastosowano napięcie, wyprodukowano tajemnicze promienie, zwane promieniami katodowymi, których natura była nieznana, aż do j. J. Thomson (1856–1940) odkrył, że składały się one z ujemnie naładowanych cząstek.
Thomson uzyskał iloraz między obciążeniem a masą tych cząstek: 1.76 x 108 C/g, gdzie C oznacza kulomb, Jednostką do ładowania elektrycznego w międzynarodowym systemie jednostek i G jest gram.
Może ci służyć: światła załamanie: elementy, prawa i eksperymentI znalazł dwie bardzo ważne rzeczy, pierwsze, że masa cząstek była bardzo mała, a po drugie, że wartość ta była taka sama dla wszystkich, niezależnie od tego, jakie elektrody zostały wykonane.
Wartość obciążenia znaleziono wkrótce potem, na początku XX wieku, amerykański fizyk Robert Millikan (1868–1953) i jego współpracowników, dzięki eksperymentowi spadek oleju.
Jądro atomowe: protony i neutrony
 Portret Henri Becquerel
Portret Henri Becquerel Pod koniec XIX wieku Henri Becquerel (1852–1908) odkrył zjawisko naturalnej radioaktywności, które zaintrygowało innych fizyków, takich jak małżonkowie Marie i Pierre Curie, a także neozygotyczne Ernest Rutherford.
Ten ostatni znalazł trzy różne rodzaje promieniowania z próbek uranu, dobrze znany element radioaktywny. Nazwał je pierwszymi trzema literami greckiego alfabetu: α, β i γ.
Eksperymenty z dyspersją Rutherford
 Młody Ernest Rutherford
Młody Ernest Rutherford Za pomocą cząstek α, bardzo energetycznego i dodatnio załadowanego, Rutherford Bombard.
Ale co ciekawe, niewielka część cząstek została odwrócona, a kilka nawet odbijanych w przeciwnym kierunku. Ten ostatni był niewyobrażalny, ponieważ, jak powiedział Rutherford, to było jak strzelanie z karabinem cienką chusteczką i zobaczenie, że pociski powracają.
Powodem, dla którego cząstki α odchylają się, jest to, że w arkuszu jest coś, co je odpycha i dlatego musi być dodatnio naładowane. Jest to jądro atomowe, niewielkie, ale zawiera prawie całą masę atomu.
Odkrycie neutronów
 James Chadwick
James Chadwick Neutron trwał nieco dłużej i był spowodowany angielskim fizykiem Jamesem Chadwick (1891–1974), studentem Rutherford. Sam Rutherford zaproponował istnienie cząstki bez obciążenia w jądrze, aby wyjaśnić, dlaczego nie jest to rozpadowe z powodu odpychania elektrostatycznego.
Eksperymenty Chadwicka ujawniono w 1932 r. Istnienie masy masy bardzo podobnej do istnienia protonu, ale bez obciążenia. Właśnie dlatego nazywali ją neutronem i obok protonu, są podstawowymi elementami jądra atomowego.
Może ci służyć: energia elektromagnetyczna: wzór, równania, zastosowania, przykładyGłówne cząstki subatomowe
Zasadniczo cząstki subatomowe charakteryzują się posiadaniem:
- Masa.
- Ładunek elektryczny.
- Kręcić się.
Spin jest wysokiej jakości analogiczną do obrotu na osi, ale o całkowicie kwantowej naturze. Z drugiej strony istnieją cząstki o obciążeniu i masie 0, takie jak foton.
Elektron
Elektron jest stabilną cząsteczką subatomową, negatywnie obciążoną i należącą do grupy Leptones, będącą tą o najniższej masie. Jest to istotna część atomu, jednak może istnieć od izolowania, w formie darmowe elektrony.
W rzeczywistości jest to najmniejszy ładunek elektryczny, który można znaleźć w naturze, więc każda inna to wielokrotność elektronu, zgodnie z zasadą kwantyzacji obciążenia.
Jego główne cechy to:
- Masa: 9.1 x 10-31 kg
- Ładowanie: e = -1.6 x 10-19 C
- Spin: ± ½
- Antiparticle: pozytron.
Elektron jest odpowiedzialny za tworzenie wiązań chemicznych, a także w przewodzie elektrycznym i termicznym. I dzięki mechanikom kwantowym wiemy, że elektron ma podwójne zachowanie: fala i cząsteczka jednocześnie.
Proton
Jest to cząstka obciążona elektrycznie, której obciążenie jest takie samo pod względem wielkości jak elektron, ale z przeciwnego znaku.
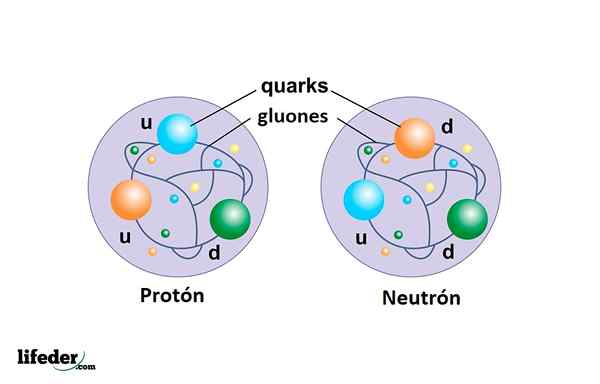
Proton nie jest cząsteczką elementarną jak elektron, ale składa się z trzech kwarków zjednoczonych przez Gluones I jest o wiele bardziej ogromny niż elektron.
W przeciwieństwie do tego proton ogranicza się do jądra atomowego, a jego ilość określa, jaki jest element, a także jego właściwości.
- Masa: 1.672 x 10-27 kg
- Ładowanie: e = +1.6 x 10-19 C
- Spin: ½
- Antiparticle: Antiproton.
Neutron
Neutron obok protonu tworzy jądro atomowe, a także składa się z trzech kwarków: dwóch typów W dół i jeden typu W GÓRĘ.
- Masa: 1.675 x 10-27 kg
- Brak obciążenia netto.
- Spin: ½.
Jest to stabilna cząsteczka w jądrze atomowym, ale jako wolna cząstka maleje z pół -liderem wynoszącym około 10.Około 3 minuty. Jego masa jest ledwo większa niż w przypadku protonu i jak powiedzieliśmy, brakuje jej obciążenia netto.
Może ci służyć: utajone ciepłoLiczba neutronów atomu jest ważna, ponieważ chociaż nie określa natury elementu, podobnie jak proton, określa klasę izotopów.
Izotopy elementu są tych samych, a ich zachowanie może być zupełnie inne od siebie. Istnieją stabilne i niestabilne, na przykład wodór ma jako izotopy deuter i tritium.
Bombardując atomy neutronów niektórych związków uranu i plutonu, jądro jest futrem. Zachodząca reakcja łańcucha jądrowego jest zdolna do emitowania dużej ilości energii.
Kwarki

Są składnikami protonów i neutronów. Do tej pory znaleziono 6 rodzajów kwarków, ale żadna jako wolna cząstka, ale powiązana z tworzeniem innych cząstek kompozytowych.
Dowody jego istnienia uzyskano poprzez eksperymenty przeprowadzone od lat 60., z liniowym akceleratorem Stanford, a następnie w CERN.
- Obciążenie: +2/3e, -1/3e
- Spin: ½
- Antiparticle: Antykark.
Inne cząstki
Od 1930 r. Standardowy model cząstek rozważa istnienie 17 rodzajów podstawowych cząstek, między kwarkami, leptonami, bozonami i bozonem Higgs.
Mają także odpowiednie przeciwdziałki, które podczas interakcji są unicestwione, generując nowe cząstki. Tutaj jest kilka z nich:
-Pozytron, identyczny z elektronem, ale z dodatnim obciążeniem.
-Neutrino, bez obciążenia.
-mezon.
-Bozony, które są nosicielami podstawowych interakcji, z wyjątkiem grawitacji.
-Bozon Higgsa, odpowiedzialny za masę.
-Gravitón, jest proponowaną cząsteczką do wyjaśnienia grawitacji, ale nadal nie ma dowodów na to, że istnieje.
Bibliografia
- Chang, R. 2013. Chemia. 11va. Wydanie. MC Graw Hill Education.
- COBIAN, J. Standardowy model cząstek. Wyjazd z: SNE.Jest.
- Fernández de Sala, p. Cząstki elementarne, cząstki złożone i wirtualne cząstki. Odzyskane od: IFIC.UV.Jest.
- Giambattista, a. 2010. Fizyka. 2. Wyd. McGraw Hill.
- Olmo, m. Protony i neutrony. Odzyskane z: Hiperphysics.Phy-orst.GSU.Edu.

