Oxácido

- 1642
- 205
- Paweł Malinowski
 Cząsteczka kwasu perspektywicznego, bardzo rzadki kwas okso z Tecnecio. Źródło: Jynto, Wikimedia Commons
Cząsteczka kwasu perspektywicznego, bardzo rzadki kwas okso z Tecnecio. Źródło: Jynto, Wikimedia Commons Co to jest oksyd?
A Oxácido, U oxoacid, jest to kwas zawierający tlen. Składa się z wodoru, tlenu i elementu niemetalicznego, który stanowi SO -Caled Central Atom. W zależności od liczby atomów tlenu, a zatem stany utleniania elementu niemetalicznego mogą tworzyć kilka oksyków.
Oxcacidy mają wiele zastosowań, które są ogólnie trudne do opisania. Jego zastosowanie będzie zależeć znacznie od środkowego atomu i liczby tlenu.
Mogą służyć ze związków do syntezy materiałów, nawozów i materiałów wybuchowych, nawet do celów analitycznych lub produkcji napojów bezalkoholowych, ponieważ występuje w przypadku kwasu węglowego i kwasu fosforowego, H, H3PO4, będąc częścią składu tych napojów.
Charakterystyka i właściwości oksykacydu
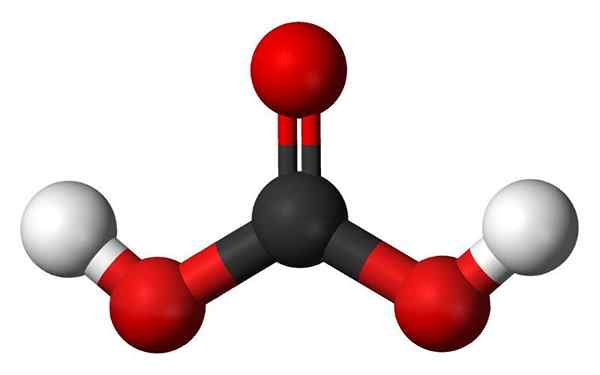 Cząsteczka kwasu węglowego. Źródło: Jynto i Ben Mills, Wikimedia Commons
Cząsteczka kwasu węglowego. Źródło: Jynto i Ben Mills, Wikimedia Commons - Grupy hydroksylowe: Jedną z głównych cech Oxácido jest nie tylko, że ma on tlen, ale także jest jak grupa OH. Z drugiej strony, niektóre oksyny mają tak zwaną grupę Oxo, E = O. W przypadku kwasu fosforu ma grupę Oxo, p = o. Brakuje im atomów H, więc „nie są odpowiedzialni” za kwasowość.
- Atom centralny: Atom centralny (e) może, ale nie musi być elementem elektrounglacyjnym, w zależności od jego lokalizacji w bloku p okresowej tabeli. Z drugiej strony, tlen, nieco bardziej elektroonegatywny element niż azot, przyciąga elektronę wiązania OH, umożliwiając w ten sposób uwalnianie jonów H+. E jest zatem powiązane z grupami OH. Po zwolnieniu jonu H+ Występuje jonizacja kwasu, to znaczy nabywa ładunek elektryczny, który w jej przypadku jest ujemny. Oxcacid może uwolnić tak wiele jonów H+ Jak grupy OH mają w swojej strukturze i im więcej, tym większe będzie obciążenie ujemne.
- Siła kwaśna: Siła prawie wszystkich oksyków, które mają ten sam atom centralny (bez metalu), wzrasta wraz ze wzrostem stanu utleniania elementu centralnego, co z kolei jest bezpośrednio związane ze wzrostem liczby atomów tlenu.
Na przykład pokazano trzy serie oksydów, których siły przychodowości są uporządkowane od najmniej do największego:
H2południowy zachód3 < H2południowy zachód4
Hno2 < HNO3
Hclo < HClO2 < HClO3 < HClO4
W większości oksyków, które mają różne pierwiastki o tym samym stanie utleniania, ale należąc do tej samej grupy stolika okresowej, siła kwasowości wzrasta bezpośrednio wraz z elektroonegatywnością atomu centralnego:
H2Seo3 < H2południowy zachód3
H3PO4 < HNO3
Hbro4 < HClO4
Tworzenie okscacidów
Jak wspomniano na początku, Oxácidos są wytwarzane, gdy niektóre substancje, zwane tlenkami kwasowymi, reagują z wodą. Zostanie to wyjaśnione przy użyciu tego samego przykładu kwasu węglowego.
Co₂+h₂o h2WSPÓŁ3
Tlenek kwasu + woda => Oxácido
To, co się dzieje, polega na tym, że cząsteczka H₂o kowalencyjnie wiąże. Jeśli woda zostanie wyeliminowana przez ciepło, równowaga do regeneracji Co₂ porusza się, to znaczy napój z napojami gorącymi.
Z drugiej strony, tlenki kwasowe powstają, gdy element niemetaliczny reaguje z wodą, chociaż dokładniej, gdy reagujący element tworzy tlenek o kowalencyjnym charakterze, którego roztwór w wodzie wytwarza hones h jonów H+.
Powiedziano już, że jony h+ Są produktem powstałej jonizacji oksykacji.
Przykłady szkolenia
Tlenek chlorowy, CL2ALBO5, Reaguj z wodą, aby podać kwas chlorowy:
Cl2ALBO5 + H₂o => hclo3
Tak więc tlenek siarkowy3, Reaguje z wodą, tworząc kwas siarkowy:
południowy zachód3 + H₂o => h2południowy zachód4
I tlenek periódiczny, ja2ALBO7, reaguje z wodą, tworząc kwas okołowy:
Siema2ALBO7 + H₂o => hio4
Oprócz tych klasycznych mechanizmów tworzenia się oksykacji, istnieją inne reakcje w tym samym celu.
Może ci służyć: reakcja endotermicznaNa przykład fosfor trichlorek, PCL3, Reaguje z wodą, wytwarzając kwas fosforowy, oksácido i kwas chlorowodorowy, kwas halohydowy.
PCL3 + 3H2O => h3PO3 + HCl
I pentachlorek fosforu, PCL5, reaguje z wodą, aby podać kwas fosforowy i kwas solny.
PCL5 + 4 h₂o => h3PO4 + HCl
Metalowe oksy
Niektóre metale przejściowe tworzą tlenki kwasowe, to znaczy rozpuszczają.
Tlenek manganu (VII) (anhydrum permanganiczny) Mn2ALBO7 A tlenku chromu (VI) są najczęstszymi przykładami.
Mn2ALBO7 + H₂o => hmno4 (kwas nadmanżowy)
Cro3 + H₂o => h2Cro4 (kwas chromowy)
Nomenklatura
Obliczanie Walencji
Poprawnie wyznaczyć Oxácid. Zaczynając od formuły heo ogólnej, rozważane są następujące:
- O ma Valencia -2.
- Valencia de los h es +1.
Mając to na uwadze, Oxácid. Zatem masz następującą sumę algebraiczną:
-2 + 1 + e = 0
E = 1
Dlatego E jest +1 Walencja.
Wówczas możliwe wartości, które mogą mieć i. Jeśli wśród ich wartości to wartości +1, +3 i +4, a następnie „pracuj” z jej mniejszą Walencją.
Nazwij kwas
Aby mianować Heo, zaczyna nazwać go kwasem, a następnie nazwę E z sufiksami -ico, jeśli pracujesz z największą walencją lub -ono, jeśli pracujesz z nieletnim. Gdy są trzy lub więcej, hipo-prefiks są używane w odniesieniu do nieletnich i większych wartości.
W ten sposób Heo byłby nazywany:
Kwas czkawka(Nazwa e)niedźwiedź
Ponieważ +1 jest najmniejszym z trzech wartości. A gdyby to był heo2, Wtedy miałbym Walencję +3 i byłby nazywany:
Może ci służyć: difenyloaminaKwas (e)niedźwiedź
I w ten sam sposób dla Heo3, Z E współpracując z Walencją +5:
Kwas (e)i co
Przykłady
- Kwas kromowy (h2Cr2ALBO4). Jest to silny, niestabilny kwas w wysokich temperaturach.
- Kwas dikromowy (h2Cr2ALBO7). Jego obecność jest zauważalna w mieszaninach kwasu chromowego stosowane do czyszczenia szkła.
- Hipochlorysty kwas (HCLO). Szybko napraw tkanki skóry.
- Kwas brany (HBRO2). Jest to związek pośredni, niestabilny. Związek bromo.
- Kwas ortofosforowy (h3PO4). Irytujący kwas dla skóry niefuelowej.
- Kwas nadmagański (hmno4). Bardzo silny kwas.
- Kwas okołowy (hio4). W chemii organicznej służy do analizy struktur innych cząsteczek.
- Kwas bromowy (HBRO3). Oxcacid bromu. Jego sole silnie utleniają.
- Kwas hipobromowy (HBRO). Jest stosowany w rozcieńczonym roztworze wodnym i jest uzyskiwany przez reakcję między wodą a BR2.
- Kwas metafosforowy (HPO3). Bardzo żrący, bezbarwny i solidny toalety w temperaturze pokojowej.
- Kwas jodowy (hio3). Reaktywnie stosowane do wykrywania morfiny w produkcie.
- Kwas siarki (h2południowy zachód3). Powodując kwaśny deszcz.
- Kwas siarkowy (h2południowy zachód4). Regularnie w zakresie przetwarzania metalu i nawozów, jest to jeden z najczęściej stosowanych związków chemicznych.
- Kwas azotowy (HNO3). Odczynnik laboratoryjny, bardzo niebezpieczny, ponieważ może spalić skórę.
- Kwas chlorowy (HCLO3). Podczas rozkładu produkuje wiele produktów. Jest stabilny na zimno do 30% stężenia.
- Kwas arsenioso (h3Aso3). Zawiera arsen i jest bardzo toksyczny i rakotwórczy. Jest stosowany w herbicydach i pestycydach.
- Kwas ortokokomiczny (h4Sio4). Słaby kwas stosowany jako środek wspierający lub osuszający.
- Kwas węglowy (h2WSPÓŁ3). Służy do robienia napojów bezalkoholowych.
- Kwas azotu (hno2). W roztworze jest niezwykle zdysocjowany.
- Kwas metaboryczny (HBO2). Lekko rozpuszczalny krystaliczny biały stał stały.
Bibliografia
- Wspólne związki oksoacidowe. Wyzdrowiał z Thoughco.com.

