Notacja spektralna

- 1335
- 141
- Prokul Woliński
 Tabela wskazująca poziomy i orbitale
Tabela wskazująca poziomy i orbitale Co to jest notacja spektralna?
Notacja spektralna Jest to układ elektronów na poziomach energii wokół jądra atomu. Według starego modelu atomowego Bohra elektrony zajmują kilka poziomów na orbitach wokół jądra, pierwszej warstwy najbliższej jądra, K, do siódmej warstwy, Q, która jest najdalej od jądra.
Pod względem bardziej wyrafinowanego modelu mechanicznego kwantowego warstwy K-Q są podzielone na zestaw orbitali, z których każdy może być zajęty przez nie więcej niż kilka elektronów.
Zwykle konfiguracja elektroniczna jest używana do opisania orbitali atomu w jego podstawowym stanie, ale można ją również użyć do reprezentowania atomu, który został zjonizowany w kationie lub anionie, kompensując utratę lub wzmocnienie elektronów w odpowiednich orbitalach.
Wiele właściwości fizycznych i chemicznych elementów może być skorelowane z ich unikalnymi konfiguracją elektroniczną. Elektrony Valencia, elektrony w zewnętrznej warstwie, są czynnikiem decydującym o unikalnej chemii pierwiastka.
Kiedy elektrony najbardziej zewnętrznej warstwy atomu otrzymują energię z pewnego rodzaju, przechodzą do większych warstw energii. Zatem elektron w warstwie K zostanie przeniesiony do warstwy L w stanie największej energii.
Gdy elektron powraca do swojego stanu podstawowego, uwalnia energię, którą pochłaniał, emitując widmo elektromagnetyczne (światło). Ponieważ każdy atom ma specyficzną konfigurację elektroniczną, będzie on także miał specyficzne widmo, które będzie nazywane widmem absorpcji (lub emisji).
Z tego powodu termin notacja spektralna jest używana w odniesieniu do konfiguracji elektronicznej.
Jak określić notację widmową: liczby kwantowe
W sumie cztery liczby kwantowe są używane do całkowitego opisania ruchu i trajektorii każdego elektronu wewnątrz atomu.
Połączenie wszystkich liczb kwantowych wszystkich elektronów w atomie jest opisane przez funkcję falową, która spełnia równanie Schrödingera. Każdy elektron w atomie ma unikalny zestaw liczb kwantowych.
Może ci służyć: ułamek molowy: jak jest obliczany, przykłady, ćwiczeniaZgodnie z zasadą wykluczenia Pauliego, dwa elektron nie mogą dzielić tej samej kombinacji czterech liczb kwantowych.
Liczby kwantowe są ważne, ponieważ można je wykorzystać do określenia konfiguracji elektronicznej atomu i prawdopodobnej lokalizacji elektronów atomowych.
Liczby kwantowe są również wykorzystywane do określenia innych cech atomów, takich jak energia jonizacyjna i promień atomowy.
Liczby kwantowe oznaczają określone skorupy, podczelności, orbitale i elektrony.
Oznacza to, że całkowicie opisują charakterystykę elektronu w atomie, to znaczy opisują każde pojedyncze rozwiązanie równania Schrödingera lub funkcji fali, elektrony w atomie.
Istnieje w sumie cztery liczby kwantowe: główna liczba kwantowa (N), liczba kwantowa orbitalnej kątowej (L), magnetyczna liczba kwantowa (ml) i liczba kwantowa spin elektronowego (MS).
Główna liczba kwantowa, NN, opisuje energię elektronu i najbardziej prawdopodobną odległość elektronu rdzenia. Innymi słowy, odnosi się do wielkości orbity i poziomu energii, na którym umieszczany jest elektron.
Liczba podkładek lub LL opisuje formę orbity. Można go również użyć do określenia liczby węzłów kątowych.
Magnetyczna liczba kwantowa, ML, opisuje poziomy energii w podkapie i więcej odnosi się do spinu elektronu, który może być w górę lub w dół.
Zasada Aufbau
Aufbau pochodzi od niemieckiego słowa Aufbauen, Co oznacza „budowa”. Zasadniczo pisząc konfiguracje elektronów, budujemy orbitale elektronowe, gdy przechodzimy z jednego atomu do drugiego.
Gdy piszemy elektroniczną konfigurację atomu, wypełnimy orbitale w rosnącej kolejności liczby atomowej.
Zasada Aufbau pochodzi z zasady wykluczenia Pauli, która mówi, że nie ma dwóch fermionów (na przykład elektronów) w atomie.
Może ci służyć: kwas butynowy: wzór, właściwości, ryzyko i zastosowaniaMogą mieć ten sam zestaw liczb kwantowych, więc muszą „gromadzić się” na wyższych poziomach energii. Jak gromadzą się elektrony, jest tematem ustawień elektronów.
Stabilne atomy mają tyle elektronów, jak protony w jądrze. Elektrony zbierają się wokół jądra w orbitalach kwantowych zgodnie z czterema podstawowymi zasadami zwanej zasadą Aufbau.
1. W atomie nie ma dwóch elektronów, które dzieliły te same cztery liczby kwantowe N, L, M i S.
2. Elektrony najpierw zajmie orbitale o najniższym poziomie energii.
3. Elektrony wypełnią orbitale zawsze tym samym numerem spinu. Kiedy orbitale będą pełne, rozpocznie się.
4. Elektrony wypełnią orbitale dla sumy liczb kwantowych N i L. Orbitale o równych wartościach (n + l) zostaną najpierw wypełnione niższymi wartościami N.
Druga i czwarta zasadach są w zasadzie takie same. Przykładem reguły czwartej byłyby orbitale 2p i 3s.
Orbital 2p wynosi n = 2 i l = 2, a orbital 3s wynosi n = 3 i l = 1. (N + l) = 4 W obu przypadkach, ale orbital 2p ma najniższą energię lub niższą wartość i zostanie wypełniony przed warstwą 3s.
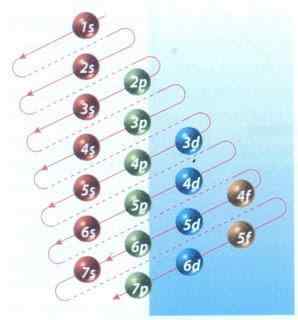 Rysunek 2: Schemat molera wypełnienia konfiguracji elektronicznej
Rysunek 2: Schemat molera wypełnienia konfiguracji elektronicznej Na szczęście możesz użyć diagramu moellera pokazanego na rysunku 2, aby wypełnić elektrony. Wykres jest odczytywany przez wykonywanie przekąt od 1S.
Rysunek 2 pokazuje orbitale atomowe i strzałki wskazują, jak śledzić.
Teraz, gdy wiadomo, że kolejność orbitali jest wypełniona, jedyne, co pozostaje, jest zapamiętywanie wielkości każdej orbity.
Orbitale mają 1 możliwą wartość mL Zawierać 2 elektrony
Orbitale P mają 3 możliwe wartości mL Zawierać 6 elektronów
Orbitale mają 5 możliwych wartości mL Zawierać 10 elektronów
Orbitale mają 7 możliwych wartościL Zawierać 14 elektronów
To wszystko, co jest potrzebne do określenia konfiguracji elektronicznej stabilnego atomu elementu.
Może ci służyć: Dodecil Siarczan sodu (SDS): Struktura, właściwości, zastosowaniaNa przykład weź element azotu. Azot ma siedem protonów, a zatem siedem elektronów. Pierwszą orbitalą do wypełnienia jest Orbital 1s. Orbital ma dwa elektrony, więc pozostało pięć elektronów.
Następny orbital to Orbital 2S i zawiera kolejne dwa. Trzy końcowe elektrony zostaną trafione na orbital 2p, który może zawierać do sześciu elektronów.
Złap zasady
Sekcja Aufbau omówiono, w jaki sposób elektrony najpierw wypełniają najniższe orbitale energetyczne, a następnie przenoszą się do najwyższych orbitali energetyczny.
Istnieje jednak problem z tą zasadą. Z pewnością 1S orbitale muszą być wypełnione przed 2s orbitale, ponieważ orbitale 1s mają niższą wartość n, a zatem niższą energię.
I trzy różne orbitale? W jakiej kolejności powinny być wypełnione? Odpowiedź na to pytanie obejmuje zasadę zatopienia.
Reguła zlewu określa, że:
- Każda orbital na poziomie podrzędnym jest zajęta indywidualnie, zanim jakikolwiek orbital zostanie podwójnie zajęty.
- Wszystkie elektrony w indywidualnie okupowanych orbitalach mają taki sam zwrot (aby zmaksymalizować całkowity obrót).
Gdy elektrony są przypisywane do orbitali, elektron najpierw stara się wypełnić wszystkie orbitale podobną energią (zwaną także degenerate orbitali), zanim dopasuje się do innego elektronu w półfullowym orbicie.
Atomy w stanach ziemskich zwykle mają jak najwięcej elektronów. Podczas wizualizacji tego procesu zastanów się, w jaki sposób elektrony wykazują to samo zachowanie, co te same bieguny w magnesie, jeśli się skontaktują.
Gdy negatywnie naładowane elektrony wypełniają orbitale, najpierw starają się uciec jak najwięcej.
Bibliografia
- Liczby kwantowe. Chem wyzdrowiał.Librettexts.org.
- Konfiguracje elektronów i właściwości atomów (s.F.). Wyzdrowiał z Oneonta.Edu.
- Elektroniczna Konfiguracja. Odzyskane z Britannica.com.

