Liczby kwantowe dla tego, jakie są zastosowanie i co są
- 4028
- 384
- Arkady Sawicki
NKwantowe umetery Służą one do opisania stanu kwantowego elektronów w atomie i pochodzą z roztworu równania Schrödingera dla najprostszego ze wszystkich: wodór.
Równanie Schrödingera jest równaniem różniczkowym, którego rozwiązania są Funkcje fali i są one oznaczone grecką literą ψ. Można podnieść nieskończone roztwory, a jego kwadrat jest równoważny prawdopodobieńowi znalezienia elektronu w niewielkim obszarze przestrzeni, zwanej orbitalny.
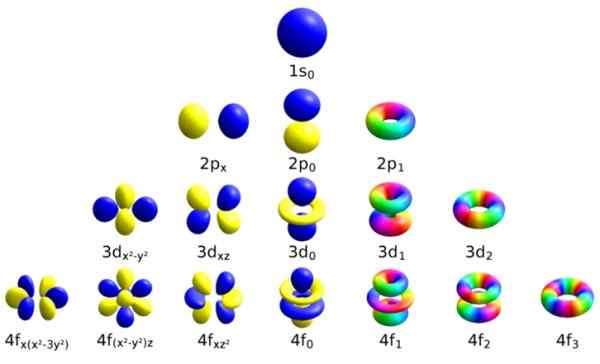
 Każdy z tych orbitali atomowych wyróżnia się określonym zestawem liczb kwantowych. Źródło: Wikimedia Commons.
Każdy z tych orbitali atomowych wyróżnia się określonym zestawem liczb kwantowych. Źródło: Wikimedia Commons. Każdy orbital ma zdefiniowane cechy, które odróżniają go od innych, takich jak energia, pęd kątowy i spin, całkowicie kwantowa właściwość elektronu i która jest odpowiedzialna między innymi za efekty magnetyczne.
Sposobem zidentyfikowania każdego orbitalu jest rozróżnienie go za pomocą zestawu liczb, które go opisują, a są to dokładnie liczby kwantowe:
-N: jest główną liczbą kwantową.
-ℓ: azimutowa liczba kwantowa.
-Mℓ, To jest liczba magnetyczna.
-MS, Numer spinowy.
[TOC]
Po co są liczby kwantowe?
Liczby kwantowe służą do opisania stanu elektronów wewnątrz atomu. Ten model atomowy, w którym elektron obraca się wokół jądra, jest niedokładny, ponieważ nie jest zgodny ze stabilnością atomową lub z dużą liczbą obserwowanych zjawisk fizycznych.
Właśnie dlatego duński Niels Bohr (1885–1962) złożył w 1913 r. Bold propozycja: elektron można znaleźć tylko w niektórych stabilnych orbitach, których rozmiar zależy od liczby całkowitych o nazwie N.
Później, w 1925 r., Austriacki fizyczny Erwin Schrödinger (1887–1961) podniósł równanie różniczkowe w częściowych pochodnych, których roztwory opisują atom wodoru. Czy funkcje falowe ψ wspomniane na początku.
To równanie różniczkowe obejmuje trzy współrzędne przestrzenne plus czas, ale kiedy nie jest uwzględnione, rozwiązanie równania Schrödingera jest analogiczne do fali stacjonarnej (fala rozprzestrzeniająca się między określonymi limitami).
Funkcje fali
Niezależne równanie czasowe Schrödingera jest rozwiązywane we współrzędnych sferycznych, a rozwiązanie jest zapisywane jako iloczyn trzech funkcji, po jednym dla każdej zmiennej przestrzennej. W tym układzie współrzędnych, zamiast korzystać z współrzędnych osi kartezjańskich X, I I z Używane są współrzędne R, θ I φ. Tą drogą:
Może ci służyć: obwód równoległyψ (r, θ, φ) = r (r) ⋅f (θ) ⋅G (φ)
Funkcja fali jest niematerialna, pomimo mechaniki kwantowej mówi nam, że kwadratowa amplituda:
| ψ (r, θ, φ) |2
To znaczy, że moduł lub wartość bezwzględna funkcji fali, kwadrat, jest liczbą rzeczywistą, która reprezentuje prawdopodobieństwo znalezienia elektronu, w określonym regionie wokół punktu, którego współrzędne są R, θ I φ.
I ten fakt jest czymś bardziej konkretnym i namacalnym.
Aby znaleźć funkcję falową, musisz rozwiązać trzy zwykłe równania różniczkowe, po jednej dla każdej zmiennej R, θ I φ.
Rozwiązania każdego równania, które będą funkcjami r (r), f (θ) i g (φ), zawierają pierwsze trzy wymienione liczby kwantowe.
Jakie są liczby kwantowe?
Poniżej krótko opisujemy charakter każdej liczby kwantowej. Pierwsze trzy, jak wspomniano powyżej, powstają z roztworów równania Schrödingera.
Czwarty numer został dodany przez Paula Dirac (1902–1984) w 1928 roku.
Główny numer kwantowy
Jest to oznaczone przez N i wskazuje wielkość dozwolonej orbity, a także energię elektronu. Im wyższa jest jego wartość, tym bardziej elektron jądra i jego energia również będzie, ale w zamian zmniejsza jego stabilność.
Liczba ta powstaje z funkcji r (r), która jest prawdopodobieństwem znalezienia elektronu w określonej odległości R jądra, który jest określany przez:

-Planck stała: h = 6626 × 10 -3. 4 J.S
-Masa elektronowa mI = 9.1 × 10-31 kg
-Obciążenie elektronów: e = 1.6 × 10-19 C.
-Stała elektrostatyczna: k = 9 × 10 9 N.M2/C2
Gdy n = 1 odpowiada promieniu BOHR, który jest wart około 5.3 × 10−11 M.
Z wyjątkiem pierwszej warstwy pozostałe są podzielone na podcze. Każda warstwa ma energię w elektronu woltowym podanym przez:
Może ci służyć: fale mechaniczne: cechy, właściwości, wzory, typy
- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- Lub (n = 5)
- P (n = 6)
- Q (n = 7).
Teoretycznie nie ma górnej granicy dla N, ale w praktyce obserwuje się, że osiąga tylko n = 8. Najmniej możliwa energia odpowiada n = 1 i jest energią Stan podstawowy.
Azymutalna liczba kwantowa lub pęd kątowy
Oznaczona przez listę kursywą liczba ta określa kształt orbitali, przy określeniu wielkości orbitalnej pędu kątowego elektronu.
Na przykład możesz wziąć całe i dodatnie wartości między 0 a N-1:
-Gdy n = 1, to ℓ = 0 i jest pojedynczy poziom.
-Jeśli n = 2, to ℓ może być warte 0 lub 1, więc masz dwa podmiejscowe poziomy.
-A jeśli n = 3, to ℓ zakłada wartości 0, 1 i 2, a są 3 podwodne.
Można go obserwować w nieskończoność, chociaż jak wspomniano wcześniej, w praktyce N osiągnie do 8. Sub -poziomy są oznaczone literami: S, P, D, F I G I zwiększają energię.
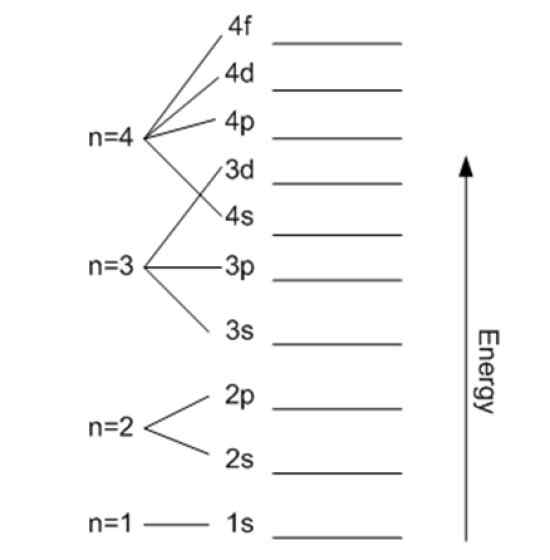 Energia jest związana z główną liczbą kwantową. Źródło: Wikimedia Commons.
Energia jest związana z główną liczbą kwantową. Źródło: Wikimedia Commons. Magnetyczna liczba kwantowa mℓ
Liczba ta decyduje o orientacji orbity w przestrzeni, a jej wartość zależy od ℓ.
Dla danego ℓ istnieją (2ℓ+1) całe wartości m ℓ, odpowiadające odpowiednim orbitale. To są:
-ℓ, ( - ℓ+1),… 0,… (+ℓ -1),+ℓ.
Przykład
Jeśli n = 2, wiemy, że ℓ = 0 i ℓ = 1, to m ℓ Weź następujące wartości:
-Dla ℓ = 0: m ℓ = 0.
-Dla ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
Orbital n = 2 ma dwa poziomy podrzędne, pierwsze z n = 2, ℓ = 0 i i ℓ = 0. Następnie mamy drugi poziom podpisu: n = 2, ℓ = 1, z 3 orbitalami:
- N = 2, ℓ = 1, m ℓ = -1
- N = 2, ℓ = 1, m ℓ = 0
- N = 2, ℓ = 1, m ℓ = +1
Trzy orbitale mają tę samą energię, ale inną orientację przestrzenną.
Liczba kwantowa spin mS
Podczas rozwiązywania równania Schrödingera w trzech wymiarach pojawiają się już liczby. Jednak w wodorze obserwuje się jeszcze dalszą strukturę, niż liczby te nie są wystarczające do wyjaśnienia.
Może ci służyć: stała Gase: co to jest, obliczenia i przykładyDlatego w 1921 r. Kolejna budowa ciała, Wolfgang Pauli, zaproponował istnienie czwartej liczby: liczby spin mS, który wymaga wartości +½ lub -½.
Z tą liczbą opisano bardzo ważną właściwość elektronu, czyli kręcić się, Słowo, które pochodzi z angielskiego kręcić się (obróć siebie). A spin z kolei jest związany z właściwościami magnetycznymi atomu.
Jednym ze sposobów zrozumienia spinu jest wyobrażenie sobie, że elektron zachowuje się jak mały dipol magnetyczny (magnes z biegunami północnymi i południowymi), dzięki obrotowi wokół własnej osi. Turn może znajdować się w tym samym kierunku co igły zegarowe lub w przeciwnym kierunku.
Chociaż Pauli zasugerował istnienie tej liczby, wyniki eksperymentu przeprowadzonego przez Otto Stern i Waltera Gerlach w 1922 roku już się tego spodziewały.
Ci naukowcom udało się podzielić wiązkę atomów srebra przez zastosowanie niejednorodnego pola magnetycznego.
Wartość mS Nie zależy to od N, ℓ i M ℓ. Graficznie jest reprezentowany przez strzałkę: strzałka w górę wskazuje harmonogram i jeden w dół przeciwhoranu.
Zasada wykluczenia Pauli
Zachowanie elektronów w atomie jest podsumowane w zasadzie wykluczenia Pauli, które stwierdza, że dwa elektrony atomu nie mogą istnieć w tym samym stanie kwantowym.
Dlatego każdy elektron musi mieć inny zestaw liczb kwantowych n, ℓ, m ℓ oraz mS.
Znaczenie liczb kwantowych i ta zasada polega na zrozumieniu właściwości pierwiastków w tabeli okresowej: elektrony są zorganizowane w warstwach według N, a następnie w sub-caps zgodnie z ℓ i resztą liczb.
Bibliografia
- Alonso, m. 1971. Fundamenty kwantowe i statystyczne. Międzyamerykański fundusz edukacyjny.
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill.
- Chang, R. 2013. Chemia. 11va. Wydanie. MC Graw Hill Education.
- Eisberg-Resnick. 1989. Fizyka kwantowa. Limusa - Wiley.
- Giambattista, a. 2010. Fizyka. 2. Wyd. McGraw Hill.
- Rex, a. 2011. Podstawy fizyki. osoba.
- Tippens, s. 1. 2011. Fizyka: koncepcje i zastosowania. 7. edycja. McGraw Hill.
- « Oskarżenie pisane treści, jak to zrobić, model
- Przykłady środowiska osadowego i ich cechy, przykłady »

