Struktura nitrobenzenu (C6H5NO2), właściwości, zastosowania, ryzyko

- 3396
- 162
- Paweł Malinowski
On nitrobenzen Jest to aromatyczny związek organiczny utworzony przez pierścień benzeniczny C6H5- I grupa nitro -no2. Jego formuła chemiczna to c6H5NIE2. Jest to kolorowy lub jasnożółty tłusty płyn, z zapachem gorzkich migdałów lub buty na buty.
Nitobenzen jest bardzo przydatnym związkiem w przemyśle chemicznym, ponieważ pozwala uzyskać serię substancji chemicznych, które mają różne zastosowania. Dzieje się tak, ponieważ może podlegać różnym rodzajom reakcji.
 Nitrobencene, c6H5-NIE2. Autor: Marilú Stea.
Nitrobencene, c6H5-NIE2. Autor: Marilú Stea. Wśród ważnych reakcji chemicznych są azotowanie (co pozwala dodać więcej grup -nie2 do cząsteczki) i redukcja (przeciwieństwo utleniania, gdy dwa atomy tlenu grupy nitro -no są eliminowane2 i są zastępowane przez hydrogeny).
Za pomocą nitrobencene możesz przygotować na przykład anilinę i para-acetaminofenol. Ten ostatni to dobrze znany acetaminofen, który jest antypieretycznym (lekiem gorączkowym) i miękkim przeciwbólowym (niewielki lek przeciwbólowy).
Nitobenzen musi być ostrożnie manipulowany, ponieważ jest irytujący i toksyczny, może powodować rodzaj niedokrwistości, wśród kilku objawów, i uważa się, że może to powodować raka. Jest również szkodliwy dla środowiska.
[TOC]
Struktura
Nitrobenzen c6H5-NIE2 Jest to płaska cząsteczka utworzona przez pierścień benzeniczny C6H5- z którym powiązana jest grupa nitro -2. Jego cząsteczka jest płaska, ponieważ istnieje elektroniczna interakcja między grupą nitro -no2 i pierścień benzenowy.
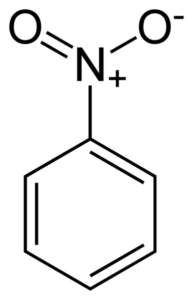 Płaska struktura cząsteczki nitrobenzenu. Elektrony podwójnych linków pierścienia bilyana mają tendencję do oddziaływania z grupą nitro -no2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Płaska struktura cząsteczki nitrobenzenu. Elektrony podwójnych linków pierścienia bilyana mają tendencję do oddziaływania z grupą nitro -no2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Grupa nitro -no2 ma tendencję do przyciągania elektronów pierścienia benzenicznego C6H5-.
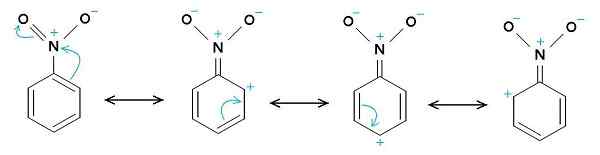 Struktury rezonansowe nitrobenzenu. Pierścień benzenowy ma zwykle obciążenie dodatnie, podczas gdy grupa nitro -NO2 ma tendencję do obciążenia ujemnego. Oryginalnym przesyłaniem był Samuele Madini na Włoskiej Wikipedii. [Domena publiczna]. Źródło: Wikimedia Commons.
Struktury rezonansowe nitrobenzenu. Pierścień benzenowy ma zwykle obciążenie dodatnie, podczas gdy grupa nitro -NO2 ma tendencję do obciążenia ujemnego. Oryginalnym przesyłaniem był Samuele Madini na Włoskiej Wikipedii. [Domena publiczna]. Źródło: Wikimedia Commons. Dlatego cząsteczka ma nieco bardziej ujemną stronę (gdzie jest tlen -no2) i nieco bardziej pozytywna strona (pierścień benzenowy).
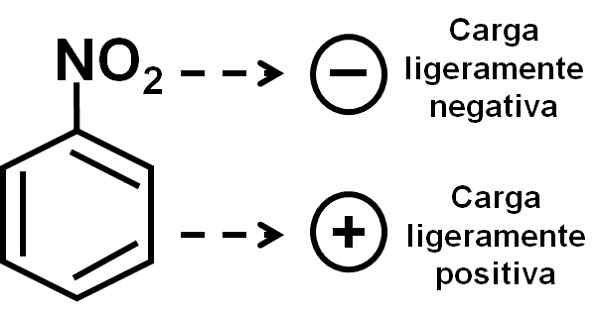 Tlen z grupy nitro ma nieznacznie ujemne obciążenie w porównaniu z pierścieniem benzenicznym. Autor: Marilú Stea.
Tlen z grupy nitro ma nieznacznie ujemne obciążenie w porównaniu z pierścieniem benzenicznym. Autor: Marilú Stea. Nomenklatura
- Nitrobenzen.
- Nitrobenze.
- Nitrobenzol.
- Olej lub esencja miRano lub Mirbana (nieużywany termin).
Nieruchomości
Stan fizyczny
Kolorowy tłusta płyn do jasnożółtego.
Waga molekularna
123,11 g/mol.
Temperatura topnienia
5,7 ° C.
Punkt wrzenia
211 ° C.
Może ci służyć: chlorek kobaltu (COCL2 (: struktura, nomenklatura, właściwościTemperatura zapłonu
88 ° C (metoda zamkniętej kubka).
Temperatura samo -kierunkowego
480 ° C.
Gęstość
1 2037 g/cm3 w 20 ° C.
Rozpuszczalność
Mało rozpuszczalny w wodzie: 0,19 g/100 g wody w 20 ° C. Całkowicie mieszane z alkoholem, benzenem i eterem dietelowym.
Właściwości chemiczne
Nitrobencen jest stabilny do około 450 ° C temperatury, w której zaczyna rozkładać się tworzenia (przy braku tlenu) nie, nr2, Benzen, bifenyl, anilina, dibenzofurano i naftalen.
Wśród ważnych reakcji nitrobencenu są redukcja, nitracja, halogenowanie i sulfonowanie.
Nitrozen nitrobenzenowy początkowo wytwarza meta-nitrobenzen i przy długim czasie reakcji otrzymuje się 1,3,5-nitobenzen.
Reagowanie bromu lub chloru z nitrobenzenem w obecności odpowiedniego katalizatora uzyskuje się 3-bromo-nitrobenzen (meta-bromonitrobencen) lub 3-cllor-nitrobenzen (meta-chloronitrobenzen).
Przykładem redukcji jest to, że w przypadku cyny (SN) w kwasie solnym (HCl) meta-halogenonitobenzenów otrzymuje się przez meta-halogenolaniny.
Sulfonowanie nitrobenzenu wykonuje się z paleniem kwasu siarkowego w 70-80 ° C, a produktem jest meta-nitrobenzeulfonowa meta-nitrobenze. Można to zmniejszyć za pomocą żelaza i HCl, aby podać kwas metanylu.
Formacja ściemniacza
W roztworze benzenowym C6H6 Cząsteczki nitrobencenu są ze sobą powiązane, tworzące średnicę lub cząsteczki pary. W tych parach jedna z cząsteczek znajduje się w pozycji odwróconej w odniesieniu do drugiej.
Tworzenie średnic nitrobenzenu z cząsteczkami jedna w odwróconej pozycji w odniesieniu do drugiej wynika prawdopodobnie z faktu, że każda z nich ma nieco bardziej pozytywną stronę i przeciwną stronę z nieco większym obciążeniem ujemnym.
W dimeru strona z nieco bardziej dodatnim obciążeniem jednej z cząsteczek jest prawdopodobnie zlokalizowana w pobliżu nieco ujemnego obciążenia drugiej cząsteczki, ponieważ przyciągane są obciążenia przeciwne, a więc zdarza się to z pozostałymi dwoma stronami.
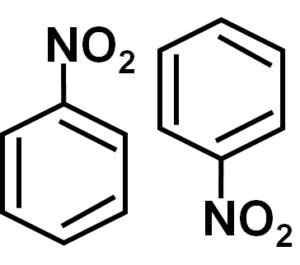 Numer nitrobencenu, to znaczy dwie cząsteczki, które zwykle są razem w niektórych rozpuszczalnikach. Autor: Marilú Stea.
Numer nitrobencenu, to znaczy dwie cząsteczki, które zwykle są razem w niektórych rozpuszczalnikach. Autor: Marilú Stea. Inne właściwości
Przedstawia zapach podobny do migdałów lub do polerowania na buty. Obniżanie jego utraty temperatury w postaci zielonkawych żółtych kryształów.
Uzyskanie
Traktujesz benzen C6H6 Z mieszaniną kwasu azotowego HNO3 i kwas siarkowy H2południowy zachód4. Proces nazywa się nitrowaniem i obejmuje tworzenie jonu nitronowego2+ Dzięki obecności kwasu siarkowego H2południowy zachód4.
- Nitronio Ion nr2+:
Hno3 + 2 godz2południowy zachód4 ⇔ h3ALBO+ + 2 HSO4- + NIE2+ (Nitronio Ion)
- Nitronio Ion atakuje benzen:
Może Ci służyć: Błąd systematyczny: jak go obliczyć, w chemii, w fizyce, przykładyC6H6 + NIE2+ → c6H6NIE2+
- Nitrobencene powstaje:
C6H6NIE2+ + Hso4- → c6H5NIE2 + H2południowy zachód4
W podsumowaniu:
C6H6 + Hno3 → c6H5NIE2 + H2ALBO
Reakcja nitrowania benzenu jest bardzo egzotermiczna, to znaczy sama wytwarzane jest, więc jest bardzo niebezpieczne.
Aplikacje
Otrzymując anilinę i acetaminofen
Nitrobencen jest używany głównie do syntezy aniliny C6H5NH2, który jest szeroko stosowanym związkiem do przygotowania pestycydów, dziąseł, barwników, materiałów wybuchowych i leków.
Uzyskanie aniliny występuje poprzez zmniejszenie nitrobenzenu w kwaśnej pożywce w obecności żelaza lub cyny, które jest wykonywane zgodnie z następującymi krokami:
Nitrobenzen → nitrosobenzen → fenylohydroksyloamina → anilin
C6H5NIE2 → c6H5Nie → c6H5NHOH → c6H5NH2
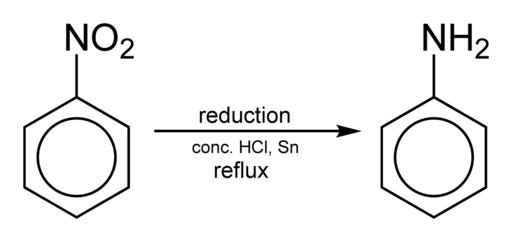 Redukcja nitrobencenu w celu uzyskania anilin. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Redukcja nitrobencenu w celu uzyskania anilin. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. W zależności od warunków proces można zatrzymać w jednym z pośrednich etapów na przykład w fenylohydroksyloaminie. Zaczynając od fenylohydroksyloaminy w silnie kwaśnym środowisku, można przygotować para-aminofenol:
Fenylhdroksyloamina → P-Aminofenol
C6H5NHOH → HOC6H4NH2
Ten ostatni jest leczony bezwodnikiem octowym w celu uzyskania paracetamolu (acetaminofenu) delikatnym przeciwbrytowatym i miękkim środkiem przeciwbólowym, to znaczy lekiem w leczeniu gorączki, bólu i bólu.
 Czasami możliwe jest leczenie acetaminofenem u dzieci z gorączką. Acetaminofen jest pochodną nitrobenzenu. Autor: Augusto Ordonez. Źródło: Pixabay.
Czasami możliwe jest leczenie acetaminofenem u dzieci z gorączką. Acetaminofen jest pochodną nitrobenzenu. Autor: Augusto Ordonez. Źródło: Pixabay.  Pigułki acetaminofenowe, pochodna nitrobenzenu. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe z Ottawa, Canadaderivative Prace: Anrie [CC przez (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons.
Pigułki acetaminofenowe, pochodna nitrobenzenu. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe z Ottawa, Canadaderivative Prace: Anrie [CC przez (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons. Innym sposobem uzyskania anilin jest zmniejszenie nitrobenzenu z tlenkiem węgla (CO) w środowisku wodnym w obecności bardzo małych cząstek (nanocząstek) paladu (PD) jako katalizatora.
C6H5-NIE2 + 3 co + h2O → c6H5-NH2 + 3 co2
Otrzymując inne związki chemiczne
Nitobenzen jest punktem wyjścia do uzyskania szerokiej gamy stosowanych związków, takich jak barwniki, pestycydy, leki i kosmetyki.
 Niektóre barwniki są uzyskiwane dzięki nitrobenzenowi. Autor: Edith Lüthi. Źródło: Pixabay.
Niektóre barwniki są uzyskiwane dzięki nitrobenzenowi. Autor: Edith Lüthi. Źródło: Pixabay. Na przykład pozwala uzyskać 1,3-dinitrobencenu, że przez chlorowanie (dodanie chloru) i redukcja (eliminacja atomów tlenu) wytwarza 3-chloroanylinę. Jest to stosowane jako pośrednik pestycydów, barwników i leków.
Nitobenzen zastosowano do przygotowania benchidiny, która jest barwnikiem. Ponadto nitrobenzen służy do przygotowania chinoliny, azobenzenu, kwasu metodylu, dyitobenzenu, izociananu lub piroksyliny wśród wielu innych związków.
W kilku aplikacjach
Nitobenzen jest używany lub używany jako:
Może ci służyć: nienasycone węglowodory- Rozpuszczalnik ekstrakcji do oczyszczania olejków smarowych stosowanych w maszynach
- Rozpuszczalnik na etyki celulozy
- Składnik mieszanki do polskich metali
- W mydłach
- W mieszankach polskich butów
- Konserwator farby w sprayu
- Komponent mieszanki polerowania podłogowego
- Migdałowy substytut esencji
- W przemyśle perfum
- W produkcji gumy syntetycznej
- Rozpuszczalnik w różnych procesach
 Nitobenzene jest częścią niektórych mieszanin do polskich butów. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licencje/by-sa/3.0/at/czyn.W)]. Źródło: Wikimedia Commons.
Nitobenzene jest częścią niektórych mieszanin do polskich butów. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licencje/by-sa/3.0/at/czyn.W)]. Źródło: Wikimedia Commons. Ryzyko
Nitobenzen jest toksyczny przez wdychanie, spożycie i wchłanianie przez skórę.
Podrażnia skórę, oczy i dróg oddechowy. Może to powodować rodzaj niedokrwistości zwanej metemoglobinemią, która polega na zmniejszeniu zdolności czerwonych krwinek do uwalniania tlenu w tkankach i generuje zmęczenie.
Ponadto nitrobencene powoduje duszność, zawroty głowy, denerwowanie, brak oddechu, upadek i śmierć. Uszkadza również wątrobę, śledzionę, nerki i ośrodkowy układ nerwowy.
Szacuje się, że może to być mutagen i prawdopodobnie powodować raka człowieka, ponieważ spowodował to u zwierząt.
Dodatkowo Nitrobencene nie należy odrzucić w środowisku. Jego toksyczność wobec zwierząt, roślin i mikroorganizmów sprawia, że jest to bardzo szkodliwe dla ekosystemów.
Toksyczność w kierunku mikroorganizmów zmniejsza jego biodegradowalność.
Leczenie jego eliminacji środowiska
Zanieczyszczenie środowiska nitobencenem może wystąpić dzięki marnotrawstwom różnych branż, które go używają.
Nitobenzen jest wysoce toksycznym i trudnym do rozbicia w warunkach naturalnych, z tego powodu może powodować poważne systemy zanieczyszczenia i siewu irygacji siewu.
Ze względu na wysoką stabilność i toksyczność wobec mikroorganizmów jest często wybierana jako model w badaniach ścieków.
Badane są różne sposoby wyeliminowania zanieczyszczonego nitrobenzenu wody. Jednym z nich jest fotokatalityczna degradacja, to znaczy użycie światła słonecznego jako akceleratora reakcji degradacji w obecności dwutlenku tytanu tytanu2.
 Z reaktorem światła słonecznego można wyeliminować zanieczyszczenie wody za pomocą nitrobencenu. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Z reaktorem światła słonecznego można wyeliminować zanieczyszczenie wody za pomocą nitrobencenu. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Metody mikroelektrolizy zostały również z powodzeniem przetestowane za pomocą katalizatora żelaza (wiara) i miedzi (Cu) w ceramice. Mikroelektroliza pozwala nitrobenzenowi rozłożyć się przez prąd elektryczny.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Nitrobenzen. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Morrison, r.T. i Boyd, r.N. (2002). Chemia organiczna. 6. edycja. Prentice-Hall.
- Mołdowoanu, s.C. (2019). Piroliza innych związków zobrazowych azotu. W pirolizy cząsteczek organicznych (wydanie drugie). Odzyskane z naukowym.com.
- Smith, s.W.G. i in. (1969). Aromatyczne związki nitrowania nitro. Podstawienia elektrofilowe. W chemii aromatycznej. Odzyskane z naukowym.com.
- Windholz, m. i in. (redaktorzy) (1983). Indeks Merck. Enyklopedia chemikaliów, leków i biologicznych. Wydanie dziesiąte. Merck & Co., Inc.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom A22. VCH Verlagsgellschaft MBH.
- Whang, t.-J. i in. (2012). Zemitowana UV fotokatalityczna degradacja nitrobenzenu przez wiązanie tytanii na rurce kwarcowej. International Journal of PhotoEnergy, tom 2012, artykuły ID 681941. Hyndawi wyzdrowiał.com.
- Shikata, t. i in. (2014). Nitrobenzen przeciw równoległym tworzeniu dimeru w rozpuszczalnikach niepolarnych. AIP Advances 4, 067130 (2014). Wyzdrowiał z DOAJ.org.
- Krogul-Obczak, a. i in. (2019). Zmniejszenie nitrobenzenu do aniliny przez CO/H2Lub w świadkach nanocząstek palladowych. Catalysts 2019, 9, 404. MDPI odzyskało.com.
- Yang, ur. i in. (2019). Produkcja pilotażowa, właściwości i zastosowanie Fe/Cu-katalitycznego-ceramicznego-cyramicznego do oczyszczania ścieków. Catalysts 2019, 9, 11. MDPI odzyskało.com.
- « Formuła przewagi mechanicznej, równania, obliczenia i przykłady
- 110 Eternal Love Frazes dla chłopaków i mężów »

