Struktura, właściwości i zastosowania azotynów potasowych (KNO2)

- 2363
- 16
- Arkady Sawicki
On Azotyn potasu Jest to sól nieorganiczna, której formuła chemiczna jest jak2, który jest chemicznie i farmakologicznie związany z azotanem potasu3. Jego wygląd fizyczny składa się z żółtawych białych kryształów, wysoce higroskopijnych, a zatem z przysmaków; to znaczy szybko rozpuszczają się w wilgotnych środowiskach.
Jego formuła wskazuje, że odsetek k jonów k+ i nie2- Jest 1: 1 i pozostaje zjednoczony przez siły elektrostatyczne lub linki jonowe. Czyste naturalne źródła najwyraźniej nie znaleziono dla swoich kryształów, chociaż nitkie aniony można znaleźć w glebach, nawozach, roślinach i zwierzętach.
 Kryształy NItal potasu. Źródło: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Kryształy NItal potasu. Źródło: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Górny obraz pokazuje, jak wyglądają kryształy Kno2, Z wyraźnymi żółtymi tonami. Jeśli kryształy te pozostaną w kontakcie z powietrzem, wchłoniły się wilgoć, aby stać się roztworem wodnym; Rozwiązanie, które wygenerowało kontrowersje w odniesieniu do tego, czy jego użycie jest korzystne, czy nie.
Z drugiej strony jego kryształy, w bardzo małych ilościach (200 ppm), są wykorzystywane do zasilania mięs i gwarancji ich ochrony przed działaniami bakteryjnymi. Również kno2 Poprawia kolor mięsa, obracając je bardziej czerwonawo; Jednak podlega kilku ograniczeniom, aby uniknąć toksycznego wpływu tej soli na ciało.
[TOC]
Struktura azotynów potasowych
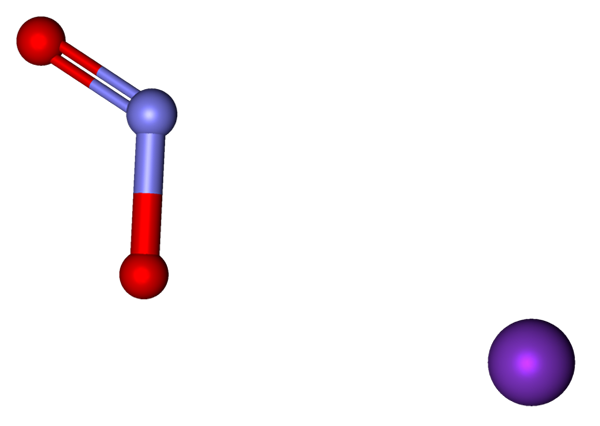 Jony, które składają się na KNO2 reprezentowane z modelem sfer i prętów. Źródło: Marinavladivok [CC0].
Jony, które składają się na KNO2 reprezentowane z modelem sfer i prętów. Źródło: Marinavladivok [CC0]. Jony obecne w azotynach potasowych pokazano powyżej. Kation k+ odpowiada fioletowej kuli, podczas gdy anion nie2- Jest reprezentowany przez niebieskawe i czerwone kulki.
Anion nr2- Jest pokazany z podwójnym wiązaniem i prostym [o = n-o]-; Ale w rzeczywistości oba linki są takie same, ponieważ rezonans ujemnego obciążenia między nimi.
Jony k+ i nie2- Przyciągają się w przestrzeni, aby zorganizować wzór strukturalny z najmniejszą energią; To, gdzie odpychanie między równymi obciążeniami są minimalne. I tak wierzą Kno Crystals2, którego komórka jednostkowa jest podatna na zmiany temperatury, które fazowe przechodzi.
Może ci służyć: Stanislao cannizzaroNa przykład w niskich temperaturach (mniej niż 25 ° C) kryształy kno2 przyjąć system monokliniczny (faza I). Gdy temperatura przekracza 25 ° C, występuje romboébiczna przejście fazy monoklinicznej (faza II). Wreszcie powyżej 40 ° C kryształy kno2 zmiana na sześcien (faza III).
Również kno2 może wykazywać inne fazy krystaliczne (fazy IV, V i VI) pod wysokim ciśnieniem. Z tym k jony+ i nie2- W końcu poruszają się i zamówili na różne sposoby w swoich czystych kryształach.
Nieruchomości
Masa cząsteczkowa
85 1038 g/mol.
Gęstość
19150 g/ml.
Temperatura topnienia
440,02 ° C (ale zaczyna rozpadać się z 350 ° C, emitujące toksyczne opary).
Punkt wrzenia
537 ° C (eksplozja).
Rozpuszczalność wody
312 g/ 100 g woda w 25 ° C.
Deliciescence
Jego rozpuszczalność w wodzie jest taka, że jest higroskopijna; tyle, co wykazuje delikatność, pochłania wystarczającą wilgoć do rozpuszczenia. To powinowactwo do wody może wynikać ze stabilności energii, którą zyskują j -jony+ Podczas nawadniania, a także nisko krystaliczna entalpia sieci dla kryształów KNO2.
Kryształy mogą wchłaniać wodę bez rozpuszczenia, aby stać się hydratem2· H2ALBO. W hydracie cząsteczka wody towarzyszy jony, które modyfikują strukturę krystaliczną.
Ten hydrat (lub kilka z nich) może być utworzony poniżej -9 ° C; W wyższej temperaturze woda rozpuszcza się i nawilża jony, deformując szkło.
Rozpuszczalność w innych rozpuszczalnikach
Lekko rozpuszczalne w gorących alkoholu i bardzo rozpuszczalne w amoniaku.
Ph
6-9. Jego wodne roztwory są zatem alkaliczne, ponieważ anion nie2- Może hydrolizować.
Nomenklatura
Do Kno2 Można go również wymienić na inne sposoby. „Azotyn potasu” odpowiada nazwie tej soli zgodnie z nomenklaturą zapasową; „Azotało potasu”, zgodnie z systematyczną nomenklaturą, w której podkreślono jedyną wartościowość potasu +1; i dioksonitan (III) potasu, zgodnie z systematyczną nomenklaturą.
Może ci służyć: Dibenzalacetona: właściwości, mechanizm reakcji, zastosowania, ryzykoDioksonitan potasu (III) podkreśla wartościowość +3 atomu azotu. Nawet nazwa najbardziej zalecana przez IUPAC dla KNO2, „Azotyn potasu” nadal jest najwygodniejszy i najłatwiejszy do zapamiętania.
Uzyskanie
Najbardziej bezpośrednim sposobem na syntetyzację, ale przy niższej wydajności jest rozkład termiczny azotanu potasu lub salet w 400 ° C lub więcej:
2KNO3 => Kno2 + ALBO2
Jednak część KNO2 ostatecznie rozkładają się według ciepła, oprócz innych produktów.
Inną metodą przygotowania lub syntetyzacji z wyższą wydajnością jest zmniejszenie KNO3 W obecności ołowiu, miedzi lub cynku. Równanie tej reakcji jest następujące:
Kno3 + Pb => kno2 + PBO
Azotan potasu i ołowiu miesza się stechiometrycznie na żelaznej patelni, gdzie łączą się z ciągłym agitacją i ogrzewaniem przez pół godziny. Tlenek ołowiu (II) jest żółty, a powstałe ciasto jest gorące i obróbce wrzącą wodą. Następnie gorąca mieszanka filtrów.
Gorące bąbelki z dwutlenkiem węgla przez pięć minut, które wytrącą węglan ołowiowy, PBCO3, nierozpuszczalny. W ten sposób prowadzenie jest zakończone. Kwas azotowy rozcieńczony do filtrowania jest dodawany, aż pH będzie neutralny, może on ostygnąć, a wreszcie woda odparowuje, aby tworzyć kryształy KNO2.
Aplikacje
Additive i odczynnik
Azotyn potasu jest używany jako dodatek do leczenia czerwonego mięsa, utrzymujący ich smak i bardziej kolor czasu podczas przechowywania, a opóźnia działanie bakteryjne i niektóre toksyny, takie jak botuliniki. Dlatego wykazuje działanie przeciwbakteryjne.
Kno2 Nie utlenia się, który reaguje z mioglobiną mięsa, a zatem modyfikuje jego naturalny czerwony kolor. Następnie, gdy mięso jest ugotowane, nabiera charakterystycznego silnego różowego koloru.
Może ci służyć: 20 przykładów sublimacji chemicznej i cechJednak w warunkach bez określenia KNO2 reaguje z białkami mięsnymi, aby zwiększyć nitrozaminę, która może stać się rakotwórcza.
Z drugiej strony kno2 (Chociaż najlepiej nano2) Jest to odczynnik analityczny, który może być stosowany w syntezie barwników azoickich (reakcja kwasu azotowego z aminami aromatycznymi) oraz w analizie aminokwasów.
Antidotum
Chociaż ma swoje negatywne efekty, Kno2 Działa jako antidotum u zatrutych pacjentów z cyjankami i wodorem. Jego mechanizm polega na utlenianiu centrów wiary2+ do wiary3+ z grup, które mamy o hemoglobinach, wytwarzających metremoglobinę, która następnie reaguje z anionami CN- i HS-.
Lekarze
W soku żołądka anion nie2- Zmniejsza się, aby nie, o czym wiadomo, że ma działanie rozszerzające naczyń, zwiększając przepływ krwi. W innych obszarach ciała, w których pH nie jest wystarczająca, niektóre enzymy, takie jak ksantina utleniona, są odpowiedzialne za zmniejszenie nie - -2-.
Kno został użyty2 w leczeniu dolegliwości i chorób, takich jak klatka piersiowa i padaczka (z bardzo negatywnymi skutkami ubocznymi).
Bibliografia
- Wikipedia. (2019). Azotyn potasu. Źródło: w:.Wikipedia.org
- PREBCHEM. (2016). Przygotowanie azotyn potasu. Odzyskany z: PrepChem.com
- Mark Gilchrist, Angela C. Brzeg, Nigel Benjamin. (2011). Azotan nieorganiczny i azotyn oraz kontrola ciśnienia krwi, badania sercowo-naczyniowe, tom 89, wydanie 3, 15 furyka 2011, strony 492-498, doi.Org/10.1093/CVR/CVQ309
- Pubchem. (2019). Azotyn potasu. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Preparat chemiczny. (2018). Azotyn potasu. Odzyskane z: preparat quimica.com
- National Center for Advancing Translational Sciences. (2011). Azotyn potasu. Odzyskane z: narkotyki.Ncats.Io
- Richard J. Eley, Paul B. Addis i Joseph J. Wartheen. (1992). Azotyn w mięsie. Uniwersytet w Minnesocie.
- N. R. Rao, ur. Prakash i m. Natarajan. (1975). Transformacje struktury krystalicznej w azotynach, azotanach i węglanach nieorganicznych. Departament Chemii, Indian Institute of Technology, Kanpur, Indie.
- « Charakterystyka mowy politycznej, typy, problemy i przykłady
- Przyczyny zanieczyszczenia śmieci, konsekwencje i przykłady »

