Azotan potasu (KNO3)
- 3594
- 704
- Pani Waleria Marek
Co to jest azotan potasu?
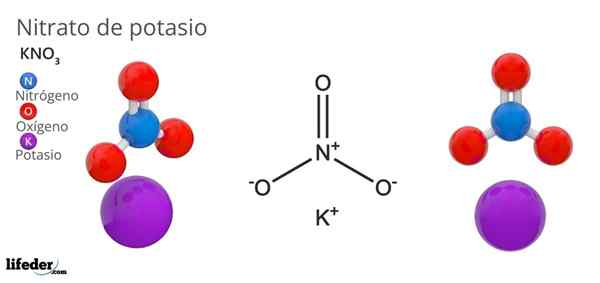
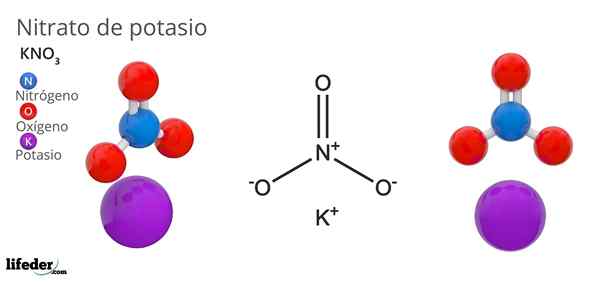
On azotan potasu Jest to trójskładnikowa sól złożona z potasu, metalu alkalicznego i oksoanionu azotanu. Jego formuła chemiczna jest kno3, Co oznacza, że dla każdego k+, Nie ma jonu3-- interakcja z tym. Dlatego jest to sól jonowa i stanowi jeden z azotanów alkalicznych (lino3, Starszy brat3, RBNO3…).
Kno3 Jest to silny środek utleniający ze względu na obecność anionu azotanu. Oznacza to, że działa jako rezerwa jonów azotanów stałych, w przeciwieństwie do innych wysoce rozpuszczalnych soli w wodzie lub bardzo higroskopijnej. Wiele właściwości i zastosowań tego związku jest spowodowane anionem azotanowym, a nie kationem potasu.
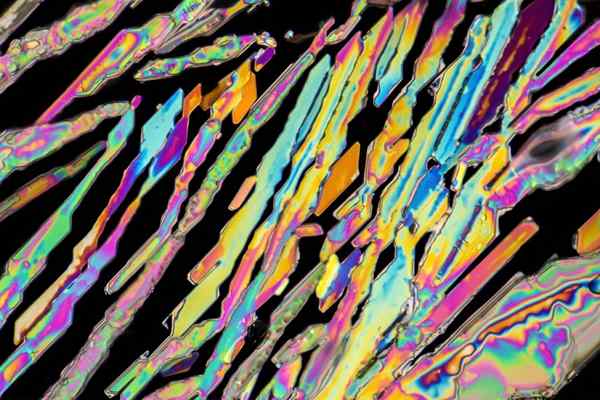 Kryształy azotanu potasu
Kryształy azotanu potasu Na górnym obrazie zilustrowano niektóre kryształy KNO3 z kształtami igieł. Naturalne źródło KNO3 jest Saletpeter, znany jako nazwy Saletra albo Balon, po angielsku. Ten element jest również znany jako azotan potassowy lub minerał nitro.
Znajduje się w obszarach suchych lub pustynnych, a także wykładzinach przepastnych ścian. Kolejne ważne źródło KNO3 To guano, odchody zwierząt zamieszkują suche środowiska.
Struktura chemiczna azotanu potasu
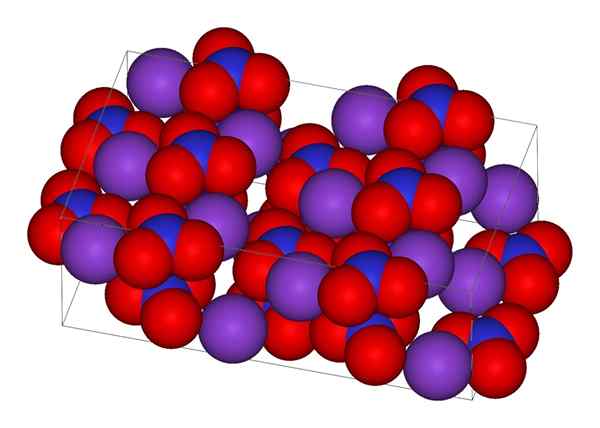 Krystaliczna struktura azotanu potasu
Krystaliczna struktura azotanu potasu Na górnym obrazie reprezentuje się krystaliczna struktura KNO3. Fioletowe kule odpowiadają jonom k+, podczas gdy czerwony i niebieski są odpowiednio atomami tlenu i azotu. Struktura krystaliczna jest ortorombowa w temperaturze pokojowej.
Nion geometria nr3- Jest to płaszczyzna trygonalna, z atomami tlenu w wierzchołkach trójkąta i atomem azotu. Przedstawia dodatnie obciążenie formalne w atomie azotu i dwa ujemne obciążenia formalne w dwóch atomach tlenu (1-2 = (-1)).
Może ci służyć: prosty mikroskopTe dwa ujemne ładunki NO3- Przenoszą się między trzema atomami tlenu, zawsze utrzymując dodatnie obciążenie azotu. W wyniku powyższych jonów k-+ kryształu, których unikają tuż nad lub poniżej azotu anionów3-.
W rzeczywistości obraz pokazuje, jak k jony+ Są otoczone atomami tlenu, czerwone kule. Podsumowując, interakcje te są odpowiedzialne za krystaliczne ustalenia.
Inne fazy krystaliczne
Zmienne, takie jak ciśnienie i temperatura, mogą modyfikować te układy i powodować różne fazy strukturalne dla KNO3 (Fazy I, II i III). Na przykład faza II jest z obrazu, podczas gdy faza I (z trygonalną strukturą krystaliczną) powstaje, gdy kryształy są podgrzewane do 129 ° C.
Faza III jest przejściową substancją stałą, która jest uzyskiwana z chłodzenia fazy I, a niektóre badania wykazały, że wykazują pewne ważne właściwości fizyczne, takie jak ferroelektryczność. W tej fazie kryształ tworzy warstwy i azotany potasu, prawdopodobnie wrażliwe na odpychanie elektrostatyczne między jonami.
W warstwach fazy III aniony nr3- Tracą trochę swojej płaskiej (nieznacznie trójkąta), aby umożliwić to układ, który przed jakimkolwiek zaburzeniem mechanicznym staje się strukturą fazy II.
Azotan potasowy używa/aplikacji
Sól ma ogromne znaczenie, ponieważ jest stosowana w licznych działaniach człowieka, które przejawiają się w przemyśle, rolnictwie, żywności itp. Zastosowania te obejmują:
- Ochrona żywności, zwłaszcza mięso. Pomimo podejrzeń, że interweniuje w tworzeniu nitrozaminy (czynnik rakotwórczy) jest nadal stosowany w węglu.
- Nawóz, ponieważ azotan potasu zapewnia dwie z trzech roślin makroskładników: azot i potas. Wraz z fosforem element ten jest niezbędny do rozwoju roślin. Oznacza to, że jest to ważna i możliwa do zarządzania rezerwat tych składników odżywczych.
- Przyspiesza spalanie, możliwość wytwarzania eksplozji, jeśli materiał palny jest rozległy lub jeśli jest drobno podzielony (większa powierzchnia, większa reaktywność). Ponadto jest to jeden z głównych elementów prochu.
- Ułatwia usunięcie dotknięć stokowanych drzew. Azotan dostarcza azot niezbędny do grzybów do zniszczenia drewna pni.
- Interweniuje w zmniejszaniu wrażliwości zębów poprzez włączenie do zębów, co zwiększa ochronę bolesnych odczuć zęba wytwarzanego przez zimno, ciepło, kwas, słodycze lub kontakt.
- Interweniuje jako hipotensor w regulacji ciśnienia krwi u ludzi. Efekt ten byłby podany lub powiązany ze zmianą wydalania sodu. Zalecana dawka w leczeniu wynosi 40-80 meq/dzień potasu. Pod tym względem wskazano, że azotan potasu miałby działanie moczopędne.
Synteza
Większość azotanów jest wytwarzana w kopalniach pustyni w Chile. Można go zsyntetyzować w kilku reakcjach:
NH4NIE3 (AC) +KOH (AC) => NH3 (Ac) +kno3 (AC)+H2Lub (l)
Azotan potasu również neutralizujący kwas azotowy z wodorotlenkiem potasu w wysoce egzotermicznej reakcji.
KOH (AC) +HNO3(conc) => kno3 (AC) +H2Lub (l)
Na skalę przemysłową azotan potasu jest wytwarzany przez reakcję podwójnego przemieszczenia.
Starszy brat3 (ac) +kcl (ac) => NaCl (ac) +kno3 (AC)
Głównym źródłem KCl jest Mineral Silvina, a nie inne minerały, takie jak Carnalite lub Kainit, które składają się również z jonowego magnezu.
Fizyczne i chemiczne właściwości
Azotan potasu w stanie stały. Ma masę cząsteczkową 101 1032 g/mol, jest toaletą i smakiem akra soli fizjologicznej.
Jest to bardzo rozpuszczalny związek w wodzie (316-320 g/litr wody, w 20 ° C), ze względu na jej charakter jonowy i łatwość cząsteczek wody w celu rozwiązania jonu K+.
Jego gęstość wynosi 2,1 g/cm3 w 25 ° C. Oznacza to, że jest około dwa razy gęsty niż woda.
Jego temperatury topnienia (334 ° C) i gotowanie (400 ° C) wskazują na wiązania jonowe między k+ i nie3-. Są one jednak niskie w porównaniu z innymi solami, ponieważ krystaliczna energia siatkowa jest niższa dla jonów monowalentnych (to znaczy z obciążeniem ± 1), a także nie mają bardzo podobnych rozmiarów.
Może ci służyć: wskaźniki pHRozkłada się w temperaturze w pobliżu temperatury wrzenia (400 ° C) w celu wytworzenia tlenu potasu i cząsteczkowego:
Kno3(S) => kno2(s) + lub2(G)
Bibliografia
- Pubchem. (2018). Azotan potasu. Odzyskane z Pubchem.NCBI.NLM.Nik.Gov
- Crysta Act. (2009). Wzrost i udoskonalenie pojedynczego krystalicznego azotanu potasu III, KNO3. B65, 659-663.
- Marni Wolfe. (3 października 2017 r.). Ryzyko azotanów potasu. Livestrong wyzdrowiał.com
- Amethyst Galleries, Inc. (1995-2014). Niter minerałowy. Galerie odzyskały.com