Moment dipolarny sposób obliczania i przykładów

- 2908
- 23
- Gabriela Łuczak
On Moment dipolarny Jest to właściwość chemiczna, która wskazuje, w jaki sposób heterogenicznie ładunki elektryczne są dystrybuowane w cząsteczce. Jest wyrażany w jednostkach Debye, 3,33,10-30 C · m i zwykle ich wartości wynoszą od 0 do 11 d.
Związki wysoce polarne mają zwykle duże momenty dipolowe; podczas gdy apolarne, małe momenty dipolowe. Im bardziej spolaryzowane ładunki elektryczne znajdują się w cząsteczce, tym większy moment dipolowy; Oznacza to, że musi istnieć region bogaty w elektrony, δ- i inny biedny w elektronach, δ+.
 Dwie -color szkic służy jako analogia do dwóch biegunów, dodatnich i negatywnych, cząsteczki z wyraźnym momentem dipolowym. Źródło: Pexels.
Dwie -color szkic służy jako analogia do dwóch biegunów, dodatnich i negatywnych, cząsteczki z wyraźnym momentem dipolowym. Źródło: Pexels. Moment dipolowy, μ, jest wielkością wektorową, więc wpływają na niego kąty łączy, a ogólnie, struktura molekularna.
Gdy cząsteczka jest liniowa, można ją porównać z dwumulowanym szkicem. Jego ujemny koniec δ-, odpowiadałby czerwonym kolorze; Podczas gdy dodatni, δ+, byłby niebieskim kolorem. Wraz ze wzrostem wielkości obciążeń ujemnych w biegunie δ i odległości, która oddziela go od δ+, moment dipolowy wzrasta.
Chemicznie powyższe oznacza, że im większa różnica w elektroonywatywności między dwoma atomami i im dłuższa odległość, która je oddziela, tym większy moment dipolowy między nimi.
[TOC]
Jak obliczany jest moment dipolowy?
Jest uważany za kowalencyjny związek między dwoma atomami, A i B:
A-B
Odległość między dodatnim i ujemnym obciążeniami częściowymi jest już zdefiniowana przez długość jego łącza:
DOδ+-Bδ-
Ponieważ protony i elektrony mają taką samą wielkość ładunku elektrycznego, ale z przeciwnymi znakami, 1.6 · 10-19C, to jest ten, który uwzględnił przy ocenie momentu dipolowego między A i B przez następujące równanie:
Może ci służyć: różnice między związkami organicznymi i nieorganicznymiμ = δ ·D
Gdzie μ jest momentem dipolowym, δ jest obciążeniem elektronu bez znaku ujemnego i D Długość łącza wyrażonego w licznikach. Na przykład zakładając D Ma wartość 2 Å (1,10-10m) Moment dipolowy, μA-B będzie:
μA-B = (1.6 · 10-19C) · (2,10-10M)
= 3,2 · 10-29Cm
Ale ponieważ ta wartość jest bardzo mała, używana jest jednostka Deby:
μ = (3,2,10-29C · m) · (1 d/3,33 · 10-30 Cm)
= 9,60 d
Ta wartość μA-B może założyć, że łącze A-B jest bardziej jonowe niż kowalencyjne.
Przykłady
Woda
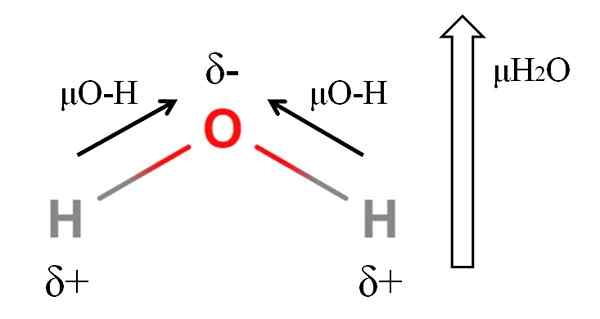 Dipoar momentu cząsteczki wody. Źródło: Gabriel Bolívar.
Dipoar momentu cząsteczki wody. Źródło: Gabriel Bolívar. Aby obliczyć moment dipolowy cząsteczki, musisz dodać wszystkie momenty dipolowe ich odpowiednich linków, biorąc pod uwagę kąty linków i odrobinę trygonometrii. To na początku.
Woda ma jedną z największych momentów dipolowych, których można się spodziewać w przypadku kowalencyjnego związku. Na górnym obrazie mamy, że atomy wodoru mają dodatnie obciążenia częściowe, δ+, podczas gdy tlen przenosi ujemne obciążenie częściowe, δ-. Link O-H jest dość polarny (1.5d), a w cząsteczce H są dwa2ALBO.
Ogólnie rzecz biorąc, wektor jest pobierany z mniej elektroungatywnego atomu (H) do najbardziej elektroongenewatywnego (O). Chociaż nie są narysowane, na atomie tlenu istnieją dwie pary niezbędnych elektronów, które „koncentrują” region ujemny jeszcze bardziej.
Z powodu geometrii kątowej H2Lub momenty dipolowe łączą się w kierunku atomu tlenu. Zauważ, że suma dwóch μO-H dałaby 3D (1.5+1.5); Ale to nie tak. Dipolowy moment wody ma wartość eksperymentalną 1.85d. Oto wpływ kąta zamknięcia 105º między łączami H-O-H.
Może ci służyć: termometr laboratoryjny: Charakterystyka, do czego służy, przykładyMetanol
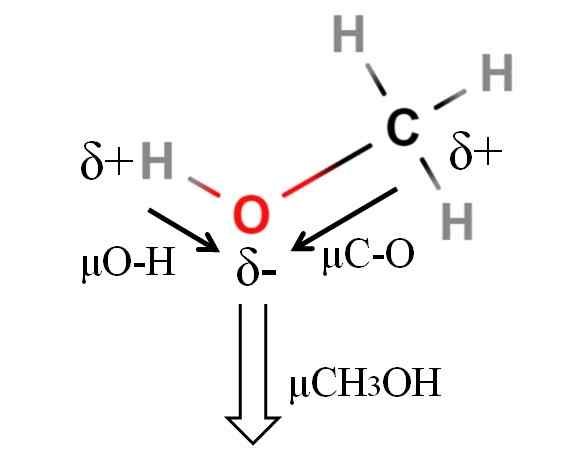 Dipoar momentu cząsteczki metanolu. Źródło: Gabriel Bolívar.
Dipoar momentu cząsteczki metanolu. Źródło: Gabriel Bolívar. Dipolowy moment metanolu wynosi 1.69d. Jest mniej niż woda. Dlatego masy atomowe nie mają zbyt dużego wpływu w momencie dipolowym; Ale jego radiotelefonie atomowe. W przypadku metanolu nie możemy potwierdzić, że twój link H-O ma μ równy 1.5 d; Ponieważ środowiska molekularne są różne w Cho3Och i h2ALBO.
Dlatego musielibyśmy zmierzyć długość łącza H-O w metanolu, aby móc obliczyć μO-H. Można potwierdzić, że μO-H jest większe niż μC-O.
Metanol jest katalogowany jako jeden z najbardziej polarnych rozpuszczalników, które można znaleźć wraz z wodą i amoniakiem.
Amoniak
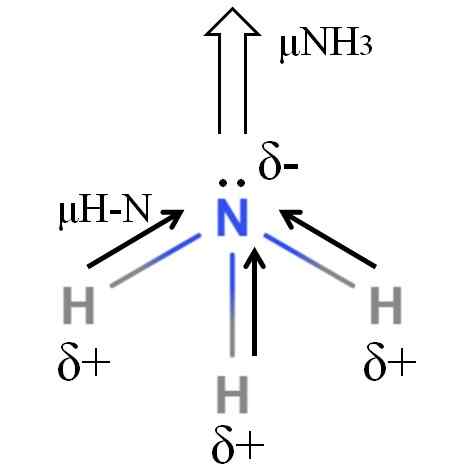 Moment dipoar cząsteczki amoniaku. Źródło: Gabriel Bolívar.
Moment dipoar cząsteczki amoniaku. Źródło: Gabriel Bolívar. Wiązania H-N są dość polarne, więc azot po jego większej elektroungatywości przyciąga do siebie elektrony (obraz doskonały). Oprócz tego, na nim mamy kilka niezapakowanych elektronów, które przyczyniają się do ich obciążeń ujemnych do regionu δ-. Dlatego ładunki elektryczne dominują w atomie azotu amoniaku.
Amoniak ma dipolowy moment 1.42d, mniej niż metanol. Gdyby zarówno amoniak, jak i metanol mogły zostać przekształcone w projekty, okaże się, że szkic metanolu ma bardziej określone bieguny w porównaniu z szkicem amoniaku.
Etanol
W przypadku etanolu, Cho3Ch2Och, twój dipolowy moment jest bardzo zbliżony do metanolu, ale ma zwykle niższe wartości. Mając więcej atomów węgla składających się z regionu δ+, atom tlenu reprezentujący δ-, zaczyna tracić nieco z „względnej intensywności ujemnej”.
Może ci służyć: dimetyloamina ((CH3) 2nh): struktura, właściwości, zastosowania, ryzykoDwutlenek węgla
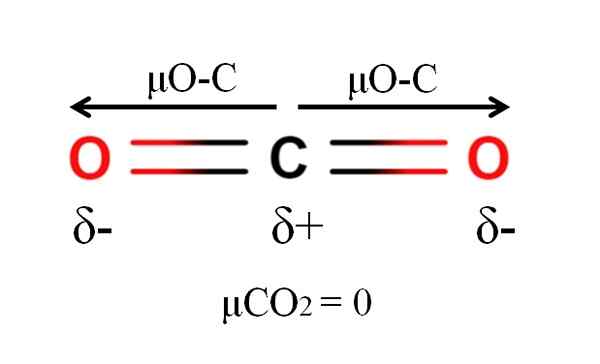 Dipoar momentu cząsteczki dwutlenku węgla. Źródło: Gabriel Bolívar.
Dipoar momentu cząsteczki dwutlenku węgla. Źródło: Gabriel Bolívar. Dwutlenek węgla ma dwa wiązania polarne, C = O, z ich odpowiednimi momentami dipolowymi μo-C. Jednak, jak widać na obrazie wyższym, liniowa geometria CO2 powoduje, że dwa μO-C anulują się nawzajem, nawet jeśli węgiel ma dodatnie obciążenie częściowe i ujemne obciążenia częściowe tlenu.
Z tego powodu dwutlenek węgla jest cząsteczką apolarną, ponieważ μco2 ma wartość 0D.
Metan
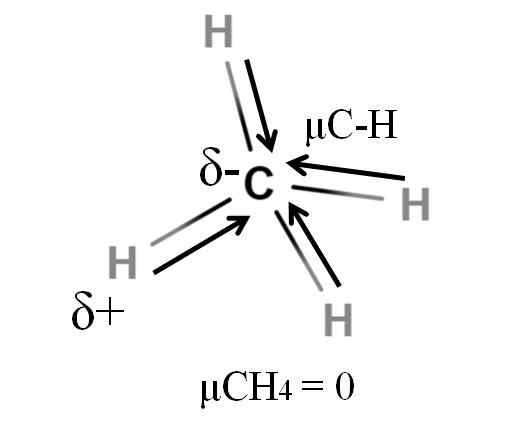 Moment dipolarny dla cząsteczki metanu. Źródło: Gabriel Bolívar.
Moment dipolarny dla cząsteczki metanu. Źródło: Gabriel Bolívar. Zarówno metan, jak i dwutlenek węgla mają coś wspólnego: są to wysoce symetryczne cząsteczki. Ogólnie rzecz biorąc, im bardziej symetryczna cząsteczka, tym mniej dipolowy będzie moment.
Jeśli widzimy cząsteczkę Cho4, Jego wiązania C-H są polarne, a elektrony są ukierunkowane w kierunku atomu węgla, ponieważ są nieco bardziej elektrowni. Można by pomyśleć, że węgiel musiałby być wysoce ujemnym regionem δ; Jako szkic z intensywnym czerwonym centrum i niebieskawe końce.
Jednak gdy Cho jest podzielony4 W połowie uzyskalibyśmy dwie połowy H-C-H, jedną po lewej, a drugą prawą, podobną do cząsteczki H2ALBO. Zatem moment dipolowy wynikający z dodania tych dwóch μC-H jest anulowany z momentem drugiej połowy. A zatem μch4 ma wartość 0D.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja, strona 479-540. MC Graw Hill.
- Helmestine, Anne Marie, pH.D. (29 stycznia 2020). Definicja momentu dipolowego. Odzyskane z: Thoughtco.com
- Blaber Mike. (29 września 2019). Dipolowe momenty. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Larita Williams. (2020). Moment dipolowy: definicja, równanie i przykład. Badanie. Odzyskane z: Study.com
- Wikipedia. (2020). Moment dipolowy wiązania. Źródło: w:.Wikipedia.org
- « Gaslighting, jak go wykryć i 5 wskazówek, aby tego uniknąć
- Charakterystyka, funkcja, typy, przykłady »

