Molalność

- 5023
- 155
- Marianna Czarnecki
Co to jest molealowość?
Molalność, oznaczony literą M małymi literami, jest to termin używany do opisania stężenia roztworu. Można go zdefiniować jako liczbę moli substancji rozpuszczonej w 1 kilogramie rozpuszczalnika.
Jest równy mole substancji substancji rozpuszczonej (substancja, która rozpuszcza się) podzielona przez kilogramy rozpuszczalnika (substancja stosowana do rozpuszczenia).

Gdzie równanie są podawane przez mole substancji rozpuszczonej:
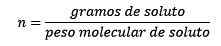
W końcu pozostaje równanie kret
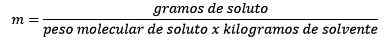
Charakterystyka moleluby
- Molalność jest miarą stężenia substancji rozpuszczonej w roztworze. Jest stosowany głównie, gdy temperatura jest problemem.
- Molelność nie jest tak powszechna jak jego odpowiednik, molowość (mole substancji rozpuszczonej dla każdego litra rozpuszczalnika), ale jest stosowana w bardzo specyficznych obliczeniach, szczególnie w odniesieniu do właściwości kajglutu (podwyższenie temperatury wrzenia, depresja punktu zamrażania). Ponieważ objętość podlega zmianom w wyniku temperatury i ciśnienia, mololowość zmienia się również w zależności od temperatury i ciśnienia.
- W niektórych przypadkach użycie wagi jest zaletą, ponieważ masa nie różni się w zależności od warunków środowiskowych.
- Ważne jest, aby zastosować masę rozpuszczalnika, a nie masę roztworu.
- Roztwory oznaczone stężeniem moralnym są wskazane małymi literami m. Roztwór 1,0 m zawiera 1 mol substancji rozpuszczonej na kilogram rozpuszczalnika.
- Przygotowanie danego rozwiązania moralności jest łatwe, ponieważ wymaga tylko dobrej skali. Zarówno rozpuszczalnik, jak i substancja rozpuszczona są mieszane, zamiast mierzyć objętość.
Może ci służyć: kwas propanowy- Jednostką SI (system międzynarodowy) dla mole jest mol/kg lub mole substancje rozpuszczalnikowe na kg rozpuszczalnika. Roztwór o mole 1 mol/kg jest często opisywany jako „1 mol” lub „1 m”.
Jednak zgodnie z systemem jednostek SI, National Institute of Standards and Technology, który jest autorytetem Stanów Zjednoczonych w zakresie pomiaru, uważa, że termin „moralny” i symbol jednostki „M” jest przestarzały i sugeruje użycie mol/kg.
Różnice i podobieństwa między molealowością (M) a molowością (M)
Przygotowanie rozwiązania danej moralności implikuje ważność zarówno substancji rozpuszczonej, jak i rozpuszczalnika i uzyskiwania jego mas.
Ale w przypadku molowości mierzona jest objętość roztworu, która pozostawia przestrzeń do zmian gęstości w wyniku warunków środowiskowych i ciśnienia.
Oznacza to, że jest to korzystna presja, gdy ciasto pozostaje niezmienione.
Ponadto reakcje chemiczne zachodzą w proporcji masy, a nie objętości. Aby polegać na ciastu, molealowość może z łatwością stać się stosunkiem masy lub frakcją masową.
W przypadku roztworów wodnych (roztworów, w których woda jest rozpuszczalnikowa) w pobliżu temperatury otoczenia, różnica między roztworami moralnymi i molowymi jest nikczemna.
Dzieje się tak, ponieważ wokół temperatury otoczenia woda ma gęstość 1 kg / l. Oznacza to, że „przez l” molowości jest równe „przez kg” molelualności.
Może ci służyć: wapń kazeinian: struktura, właściwości, uzyskiwanie i zastosowaniaW przypadku rozpuszczalnika, takiego jak etanol, gdzie gęstość wynosi 0,789 kg / l, roztwór 1 m wynosiłby 0,789 m.
Ważną częścią zapamiętywania różnicy jest:
Molarność - M → mole na litr roztworu.
Molowość - M → mole na kilogram rozpuszczalnika.
Przykłady moleluby
Przykład 1
Problem: Jaka jest moralność rozwiązania zawierającego 0.086 mole NaCl rozpuszczone w 25,0 g wodzie?
Odpowiedź: W tym przykładzie stosuje się bezpośrednie równanie moralne:
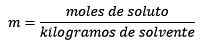
Mole substancji rozpuszczonej (NaCl) = 0,086 mol
Masa (woda) = 25,0 g = 25,0 x 10-3 kg
Zastąpienie masz:
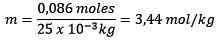
Przykład 2
Problem: Jaka jest moralność rozwiązania, jeśli 124,2 gramów NaOH rozpuści się w 1,00 litrach wody? (Gęstość wody jest równa 1,00 g/ml).
Odpowiedź: Woda jest znana jako uniwersalny rozpuszczalnik, a gęstość jest zwykle podawana około 1,00 gramów na mililitr lub co jest takie samo, 1 kilogram na litr. Ułatwia to konwersję z litrów na kilogramy.
W tym problemie 124,2 gramów NaOH będzie musiał zostać przekształcony w mole (dla moli substancji rozpuszczonej), a litr wody będzie musiał zostać przekształcony w kilogramy (za pomocą kilogramów rozpuszczalnika) przy użyciu gęstości.
Po pierwsze, jest masa molowa Naoh:
PO POŁUDNIUNa= 22,99 g/mol
PO POŁUDNIUALBO= 16 g/mol
PO POŁUDNIUH= 1 g/mol
PO POŁUDNIUNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Po drugie, gramy Naoh przekształcają się w mole, używając ciasta molowego:
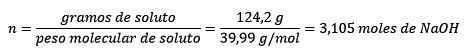
Po trzecie, litr wody staje się kilogramami przy użyciu gęstości:
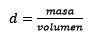
Oczyszczanie ciasta pozostaje:
Może ci służyć: Złoty tlenek (III) (AU2O3): Co to jest, struktura, właściwości, używa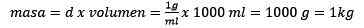
Wreszcie równanie molelizmu jest rozwiązane:
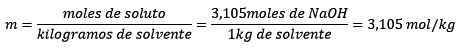
Przykład 3
Problem: Jaka jest masa wody wodnego roztworu, który zawiera 0,52 gramów chlorku baru (BACL2, PM = 208,23 g/mol), którego stężenie wynosi 0,005 mol/kg?
Odpowiedź: W tym przypadku stężenie moralne stosuje się do określenia ilości wody w roztworze.
Po pierwsze, uzyskuje się liczbę moli BACL2 W rozwiązaniu:
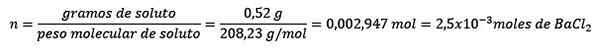
Po drugie, kilogramy rozpuszczalnika są usuwane z równania molelizmu i rozwiązane.
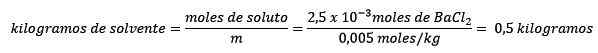
Bibliografia
- Obliczanie przykładowego problemu z molowością. Odzyskane z naukowców.org.
- Jaki jest przykład moliczności? Odzyskany po Sokratic.org.
- (S.F.). Moralność. Odzyskane z nieograniczonego.com.

