Metale alkaliczne właściwości fizyczne i chemiczne, zastosowania, uzyskiwanie
- 3406
- 520
- Prokul Woliński
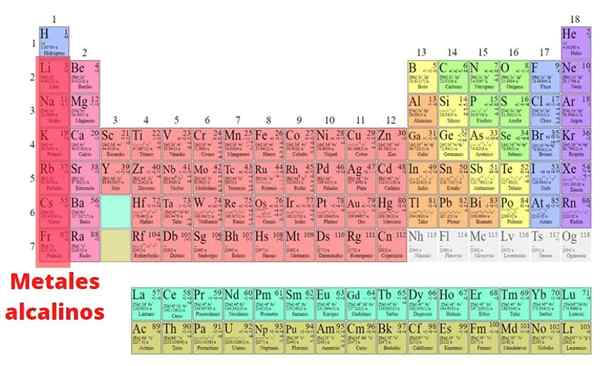
metale alkaliczne Są to elementy, które są częścią grupy I tabeli okresowej, z wyjątkiem wodoru: lit (Li), sodu (Na), potasu (k), rubidid. W przeciwieństwie do większości metali, mają niską gęstości i są bardzo reaktywne. Z powodu tej wielkiej reaktywności chemicznej nigdy nie występują w naturze w swojej podstawowej formie.
Te metale tworzą proste i stabilne związki jonowe, które w większości są rozpuszczalne w wodzie; Metale alkaliczne są zwykle łączone z halogenkiem, siarczanem, węglanem i krzemianem. Jednak niektóre elementy tworzą ograniczoną liczbę złożonych i organetalicznych związków.

Ogólnie rzecz biorąc, właściwości fizyczne i chemiczne metali alkalicznych zostały dobrze zbadane, z wyjątkiem Francio ze względu na jego radioaktywny charakter.
[TOC]
Właściwości fizyczne
- Metale alkaliczne są srebrne, z wyjątkiem cezu, które jest złote. Przeprowadzają energię elektryczną i ciepło i mają niskie temperatury topnienia, które również zmniejszają się wraz ze wzrostem liczby atomowej, ponieważ związek między atomami jest osłabiony przez zwiększenie promienia atomowego.
- Fakt posiadania tylko jednego elektronu Walencji przez Atom również sprawia, że wiązanie metalowe są słabe. W związku z tym metale alkaliczne są również wystarczająco miękkie, aby pokroić je nożem lub szpatułką.
- Wszystkie elementy przyjmują strukturę sześcienną wyśrodkowaną na ciele. Ponieważ ten rodzaj struktury krystalicznej nie jest pakowany, a radiote atomowe metali alkalicznych są duże, mają niską gęstość w porównaniu z innymi metali. W rzeczywistości lit, sód i potas unoszą się w wodzie.
- Różnice energii między orbitaliami warstwy Walencji metali alkalicznych pokrywają się z długościami fali światła widzialnego. Z tego powodu, podczas ogrzewania związków utworzonych przez te metale w płomieniu, generowane są charakterystyczne kolory.
Może ci służyć: Trinitrotolueno (TNT): Struktura, właściwości, zastosowania, ryzyko, eksplozja- W kolejności malejącej sole litowe nadają szkarłatny kolor, sole sodu żółty kolor, potas fioletowy kolor, Rubidium niebieskawy czerwony kolor i zaprzestaj niebieskiego koloru.
Właściwości chemiczne
Wszystkie metale alkaliczne mają podobieństwa w swoich właściwościach chemicznych.
- Mają elektroniczną konfigurację Walencji NS1, co przekłada się na stan utleniania +1. Z kolei oznacza to, że łatwo tracą elektron, aby osiągnąć konfigurację gazu szlachetnego.
- Zasadniczo metale alkaliczne mają najniższe energie jonizacyjne wszystkich elementów, które również zmniejszają się wraz ze wzrostem promienia atomowego w grupie, ponieważ warstwa walencji jest coraz bardziej odległa od jądra. To tłumaczy reaktywność metali alkalicznych i tworzenie jonów M+ w łatwym wodnym warunkach.
- Tendencja termodynamiczna do tworzenia jonów M+ potwierdza standardowe potencjały par m+/m, które są duże i ujemne. Taki trend oznacza, że metale alkaliczne łatwo utleniają się i mogą działać jako silne środki redukujące.
- Elementy te muszą być przechowywane w niereaktywnej oliwych, aby uniknąć reakcji z tlenem atmosferycznym. Chociaż lit, sód i potas mogą być manipulowane w powietrzu przez krótkie okres.
Uzyskanie metali alkalicznych
Sód

Najlepszy sposób na uzyskanie metalicznego sodu obejmuje elektrolizę stopionego chlorku sodu. Ponieważ temperatura topnienia chlorku sodu jest dość wysoka (808 ° C) i wymagana jest duża energia do utrzymania dużych ilości stopionej substancji, chlorek wapnia (CACL2) jest zwykle dodawany w celu zmniejszenia temperatury topnienia do około 600 ° C.
Może ci służyć: turbidymetriaSód uzyskuje się w stanie ciekłym w katodzie o czystości 99,95% w obojętnej atmosferze.
Lit i potas
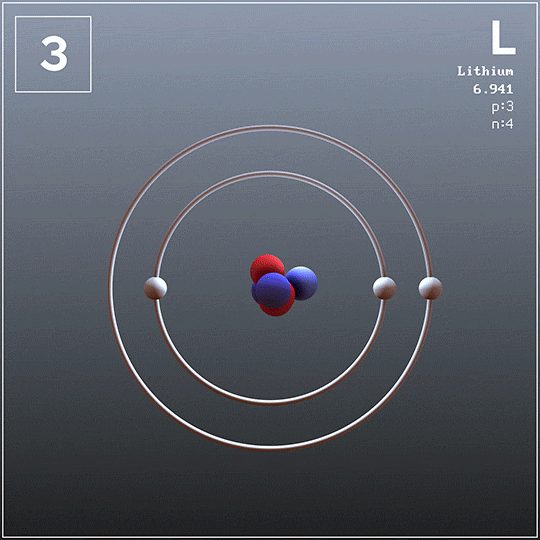
Lit można również uzyskać z chlorków odlewanych przez elektrolizę, ale nie jest taka w przypadku potasu, ponieważ jest zbyt rozpuszczalny w chlorku (KCl) i nie unosi się na powierzchni komórki. Ponadto łatwo odparowuje temperaturę roboczą, więc tworzy niebezpieczne warunki.
Dlatego potas uzyskuje się przez zmniejszenie stopionego KCl z ciekłym sodem. Sód obecny w potasie jest eliminowany przez kondensację pary w 892 ° C i przeprowadzanie frakcjonalnej destylacji metali ciekłych.
Rubidio i Cesio
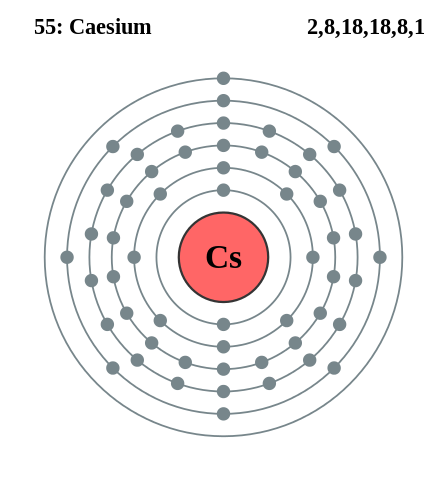 Elektroniczna konfiguracja cezu. Źródło: Pumbaa (oryginalna praca Grega Robsona) / CC BY-SA 2.0 uk (https: // creativeCommons.ORG/Licencje/BY-SA/2.0/Wielka Brytania/czyn.W)
Elektroniczna konfiguracja cezu. Źródło: Pumbaa (oryginalna praca Grega Robsona) / CC BY-SA 2.0 uk (https: // creativeCommons.ORG/Licencje/BY-SA/2.0/Wielka Brytania/czyn.W) Rubidio i cezu można uzyskać podobnie, ale używając wapnia jako środka redukującego. Metalowe cesjum można również uzyskać za pomocą stopionego elektrolizy cyjanku cewowego (CSCN).
Główne zastosowania i aplikacje
Sód jako środek redukujący
Ponieważ sód jest bardzo łatwo utleniony, jego najważniejszym zastosowaniem jest środek redukujący w celu uzyskania metali, takich jak tytan, otoczenie i hafnio. Jest również stosowany jako wymiennik ciepła w reaktorach jądrowych w swoim stanie ciekłym.
Potas jako nawóz
 Chlorek potasowy, nawóz. Źródło: Abbas Cucaniensis/CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0)
Chlorek potasowy, nawóz. Źródło: Abbas Cucaniensis/CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0) Większość przetwarzanego potasu idzie do nawozów w postaci chlorku potasu. Z kolei chlorek stosuje się w produkcji innych związków i roztworów, takich jak wodorotlenek potasu, który jest stosowany w produkcji mydeł płynnych.
Cyjanku potasu jest stosowany do ekstrakcji metalu lub powłoki, aby ułatwić osadzanie miedzi, srebra i złota. Potas można również znaleźć w niektórych materiałach wybuchowych, a jako farbowanie fajerwerków.
Może ci służyć: radio: struktura, właściwości, użycia, uzyskiwanieLit jako środek aluminiowy
Lit metalowy jest stosowany jako środek stopowy w produkcji stopów aluminiowych i magnezu aeronautycznych i lotniczych. Ale wraz z upływem czasu stwierdził, że rosnąca użyteczność jako alkaliczna anoda baterii.
Metalowe lit pozwala również zmniejszyć temperatury topnienia i spiekania niektórych rodzajów szkła i ceramiki, oprócz zmniejszenia współczynnika rozszerzania. Węglan litowy jest szeroko stosowany w leczeniu warunków dwubiegunowych, podczas gdy stearynian litu jest smarem szeroko stosowanym w przemyśle motoryzacyjnym.
Rubidio i Cesio
Rubidio i cezu są zwykle używane w tych samych zastosowaniach, więc jeden z tych elementów można zastąpić drugim. Zastosowania obejmują szkło światłowodowe w branży telekomunikacyjnej, sprzęt noktowizyjny i komórki fotoelektryczne. Zegar Cesio (zegar atomowy) jest używany do międzynarodowego standardowego miary czasu i do definicji drugiego.
Bibliografia
- Chang, R., & Goldsby, k. DO. (2016). Chemia (12. wydanie.). Nowy Jork: Mc-Graw Hill.
- Halka, m., & Nordstrom, b. (2010). Metale alkaliczne i alkaliczne. New York: InfoBase Publishing.
- Miesler, g. L., Fischer, s. 1. J., & Tarr, D. DO. (2014). Chemia nieorganiczna (wydanie 5.). Nowy Jork: Pearson.
- Mishra, ur., I Majumdar, G. (2017). Produkcja metali alkalicznych (Li, Na, K). Moduł referencyjny w dziedzinie inżynierii materiałowej i materiałów. Elsevier.
- Petrucci, r. H., Herring, f. G., Bissonnette, c., I dojrzałe, j. D. (2017). Chemia ogólna: zasady i nowoczesne zastosowania (11 wydanie.). Nowy Jork: Pearson.
- Shriver, d., Weller, m., Overton, t., Rourke, J., & Armstrong, F. (2014). Chemia nieorganiczna (wydanie 6.). Nowy Jork: W. H. Obywatel.
- « Na którym kontynent występuje większe stężenie populacji?
- Charakterystyka wieku brązu, okresy, narzędzia i wynalazki »

