Charakterystyka, struktura, funkcje
- 2484
- 195
- Eliasz Dubiel
Smozymes Są to enzymy hydrolityczne szeroko rozpowszechnione w naturze zdolne do hydrolizowania wiązań glukozydowych peptydoglikanu w ścianie bakterii. Są obecne w roślinach i zwierzętach i działają jako mechanizm obronny przed infekcjami bakteryjnymi.
Odkrycie tych enzymów sięga 1922.
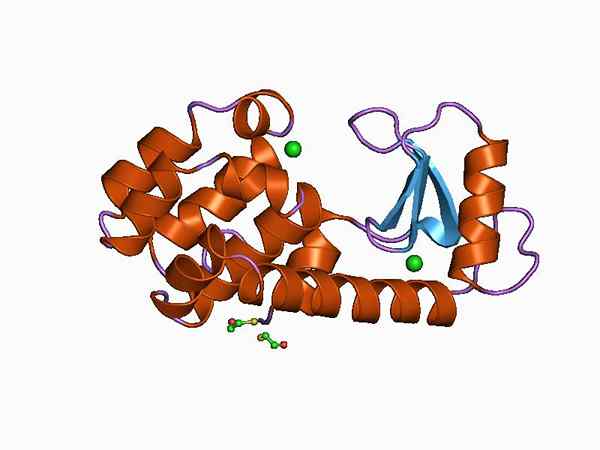
 Graficzna reprezentacja struktury gładkości (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons)
Graficzna reprezentacja struktury gładkości (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) Dzięki łatwemu zdobyciu i niewielkim rozmiarze, lizym. Obecnie jest stosowany jako system modelowy w chemii, enzymu, krystalografii i biologii molekularnej białka.
Smozym jest enzymem „bakteriolitycznym”, który specjalizuje się w hydrolizie β -1,4 glukozydowego bakterii Gram.
Ma różne funkcje, zarówno trawienne, jak i immunologiczne, we wszystkich organizmach, w których jest wyrażany i wykorzystywany jako zasób biotechnologiczny do kilku celów.
[TOC]
Charakterystyka
Gładkość są wyrażane przez główne grupy żywych organizmów na planecie, ale są szczególnie obfite u zwierząt i to z nich zostały oczyszczone i badane bardziej.
U ludzi liysze jest w wysokich stężeniach w różnych płynach i tkankach, takich jak wątroba, chrząstka, ślina, śluz i łzy. Jest wyrażany przez komórki hematopoetycznych i występuje również w granulocytach, monocytach i makrofagach, a także w innych komórkach prekursorowych.
Może ci służyć: szorstki retikulum endoplazmatyczneSmozymy podłoża pochodzenia rośliny hydrolizze podobne do tych stosowanych przez inne ściśle powiązane enzymy znane jako chitynazy, z tego powodu mogą również hydrolizować wiązania w chitynie, chociaż z mniejszą wydajnością.
Rodzaje gładkości zwierząt i ich cechy
W królestwie zwierząt opisano co najmniej trzy rodzaje gładkości:
-Gładki c („c” of "CAllonentional „lub”CHicken ", Co kurczak oznacza po angielsku)
-Smozyme G („g” z ”GOose”, Co oznacza gęś po angielsku) i
-Gładki jeden typ I („ja”Siemanvertebrates ”)
Trzy klasy koktajli różnią się od siebie w odniesieniu do ich sekwencji aminokwasowych, ich cech biochemicznych i właściwości enzymatycznych.
SLEARS Typ C
Te gładkość są uważane za „modelowe” enzymy tej rodziny, ponieważ służyły jako model badań struktur i funkcji. Są znane jako typ „C” angielskiego ”Kuck„Ponieważ po raz pierwszy izolowano je z jaj kurczaków.
W tej klasie jest gładkość wytwarzana przez większość kręgowców, szczególnie przez ptaki i ssaki. Zawiera także enzymy obecne w niektórych stawonogach, takich jak Lepidoptera, Diptera, niektóre pajęczaki i skorupiaki.
Są to małe enzymy, ponieważ mają masę cząsteczkową, która nie przekracza 15 kDa. Są to podstawowe białka z wysokimi punktami izoelektrycznymi.
SLEARS Typ G
Pierwsza gładkość tego typu zidentyfikowano w jajku przez czysty.
W niektórych przypadkach gładki typu GY są bardziej obfite niż gładko typu C w białku niektórych ptaków, podczas gdy występuje przeciwnie, gładkie CS typu C są bardziej obfite.
Może ci służyć: lenticelaTe gładkość są również obecne w mięczakach małży i niektórych tunikach. Są to nieco większe białka niż w przypadku typu C, ale ich masa cząsteczkowa zwykle nie przekracza 25 kDa.
SLEARS Typ I
Te gładkość występują przede wszystkim u zwierząt bezkręgowych. Jego obecność została określona w Anélidos, Echinoderms, skorupiakach, owadach, mięczakach i nicienie, i jest nieobecna u ssaków i innych kręgowców.
Mają bardziej kwaśne punkty izoelektryczne niż te z białek typu C i typu G.
Struktura
Trzy typy enzymów zwierzęcych opisane w poprzednim rozdziale mają dość podobne trzy wymiarowe struktury.
Gładkość ludzi jest gładkim typem C i był pierwszym z tych enzymów, które należy zbadać i scharakteryzować strukturalnie. Jest to małe białko z odpadów 130 aminokwasowych i jest kodowane przez gen zlokalizowany na chromosomie 12, który ma 4 eksony i 3 introny.
Jego struktura jest podzielona na dwie domeny: jedna znana jako domena α I kolejny podobny Domena β. Domena α składa się z czterech hal alfa, a domena β utworzona przez arkusz antyrównoległości β i dużą pętlę.
Katalityczne miejsce enzymu znajduje się w rozszczepieniu utworzonym między obiema domenami, a dla połączenia z podłożem marnuje kwas glutaminowy i kwas asparaginowy. Ponadto ma co najmniej sześć „podwodnych” znanych jako A, B, C, D, E i F, zdolnych do połączenia sześciu kolejnych marnotrawstwa cukrów.
Funkcje
Gładkość ma nie tylko funkcje fizjologiczne w ochronie i walce przed infekcjami bakteryjnymi w organizmach, które je wyrażają, ale, jak skomentowano, był bardzo przydatny jako model enzymu z chemicznego, enzymatycznego i strukturalnego punktu widzenia.
Może ci służyć: komórki nabłonkowe płaskonabłonkoweW obecnej branży jest uznawany za silny bakteriob i jest stosowany do zachowania żywności i leków.
Dzięki reakcji, że enzymy te katone mogą działać na różne populacje bakteryjne i zmieniać stabilność ich ścian, co następnie przekłada się na lizę komórek.
W połączeniu z innymi podobnymi enzymami gładkość może działać zarówno na bakteriach pozytywnych Grama, jak i na bakterie ujemne Grama, dzięki czemu można je uznać za części przeciwbakteryjnego „odpornościowego” systemu różnych rodzajów organizmów.
W białych krwinkach obecnych we krwi ssaków enzymy te mają ważne funkcje w degradacji atakujących mikroorganizmów, więc są one niezbędne dla układu odpornościowego ludzi i innych ssaków.
Smozymy w roślinach zasadniczo spełniają te same funkcje, co u zwierząt, które je wyrażają, ponieważ są pierwszą linią obrony przed patogenami bakteryjnymi.
Bibliografia
- Callewaert, L., & Michels, W. (2010). Lizozymy w królestwie zwierząt. J. Biosci., 35(1), 127-160.
- Merlini, g., & Bellotti, v. (2005). Lyszyme: paradygmatyczna cząsteczka do badań struktury białka, funkcji i niewłaściwego fałdowania. Ustawa o chemicznej klinice, 357, 168-172.
- Patrzeć. (1977). Lysezyme: krótka recenzja. Postgraduate Medical Journal, 53, 257-259.
- Sahoo, n. R., Kumar, s. 1., Bhusan, ur., Bhattacharya, t. K., Dayal, s., & Sahoo, m. (2012). Lizozym w zwierząt gospodarskich: przewodnik po selekcji. Journal of Animal Science Advances, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Loze i., & Wintjens, r. (2010). Relacje strukturalne w nadrodzinie lizozymu: znaczące dowody na motywy sygnatury hydrolazy glikozydowej. PLOS One, 5(11), 1-10.
- « Cechy Oyamel, siedlisko i dystrybucja, zastosowania
- Charakterystyka porów jądrowych, funkcje, komponenty »

