Ritchter-Wenzel Law What Is, historie, oświadczenia, przykłady
- 3768
- 1037
- Eugenia Czapla
Ritchter-Wenzel Law lub wzajemnych proporcji to taki, który stwierdza, że proporcje masy między dwoma związkami pozwalają na określenie trzeciego związku. Jest to jedno z praw stechiometrii, wraz z prawem Lavoisiera (prawo ochrony masy); Prawo Proust (prawo określonych proporcji); i prawo Daltona (prawo wielu proporcji).
Ritcher ogłosił swoje prawo w 1792 r. W książce, która zdefiniowała fundamenty stechiometrii, oparte na pracach badawczych Carla F Wenzela, który w 1777 r. Opublikował pierwszą tabelę równoważności kwasów i baz.
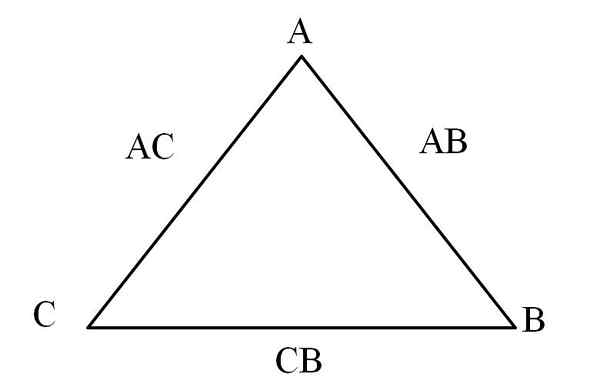
 Trójkąt wzajemności. Źródło: Gabriel Bolívar
Trójkąt wzajemności. Źródło: Gabriel Bolívar Prostym sposobem na wizualizację jest „trójkąt wzajemności” (obraz najwyższy). Jeśli znane są masy A, C i B, które są mieszane w celu utworzenia związków AC i AB, można ustalić, ile C i B są mieszane lub reakcji z utworzeniem związku CB.
W związkach AC i AB element A jest obecny w obu, więc podczas dzielenia ich proporcji masowych jest to, ile C reaguje z B.
[TOC]
Historia i ogólności prawa wzajemnych proporcji
Richter stwierdził, że część wagi związków spożywanych w reakcji chemicznej jest zawsze taka sama.
W związku z tym Ritcher stwierdził, że 615 części jest wymaganych przez wagę magnezji (MGO), na przykład do neutralizowania 1000 części o masie kwasu siarkowego.
W latach 1792–1794 Ritcher opublikował podsumowanie trzech tomów, które zawierały jego pracę nad prawem określonych proporcji. Podsumowanie wypróbowało stechiometrię, określając ją jako sztukę pomiarów chemicznych.
Może ci służyć: chromatografia warstwy: charakterystyka, do czego służyWskazując ponadto, że stechiometria dotyczy praw, zgodnie z którymi substancje są połączone w celu tworzenia związków. Jednak prace badawcze Richtera zostały skrytykowane za leczenie matematyczne, którego użył, zauważając, że dostosował swoje wyniki.
W 1802 r. Ernst Gottfried Fischer opublikował pierwszą tabelę równoważników chemicznych, która zastosowała kwas siarkowy z rysunkiem 1000; Podobne do wartości znalezionej przez Richtera, dla neutralizacji kwasu siarkowego przez magnezję.
Jednak wskazano, że Richter zbudował tabelę pesos kombinacji wskazującej na proporcja, w której zareagowało wiele związków. Na przykład wskazano, że 859 części NaOH neutralizuje 712 części HNO3.
Stwierdzenia i konsekwencje
Oświadczenie prawa Richtera-Wenzela jest następujące: masy dwóch różnych elementów, które są połączone z tą samą ilością trzeciego elementu, zachowują tę samą relację, co masy tych elementów w połączeniu ze sobą.
Prawo to zezwoliło na ustalenie równoważnej wagi lub gramy golenia, takiego jak ilość elementu lub związku, który zareaguje ze stałą ilością substancji referencyjnej.
Richter nazywał masy kombinacji związane z wagami pierwiastków, które zostały połączone z każdym gramem wodoru. Względne wadze kombinacji Richtera odpowiadają tak zwanej równoważnej wagi pierwiastków lub związków.
Zgodnie z poprzednim podejściem, prawo Richtera-Wenzela można określić w następujący sposób:
Waga kombinacji różnych elementów, które są połączone z pewną wagą danego pierwiastka, to względne wagi kombinacji tych elementów w połączeniu ze sobą lub mnożnik.
Może ci służyć: metody rozdziału heterogenicznych mieszaninPrzykłady
Chlorek wapnia
W tlenku wapnia (CAO) 40 g wapnia łączy się z 16 g tlenu (O). Tymczasem w hipochlorystycznym tlenku (Cl2O), 71 g chloru łączy się z 16 g tlenu. Jaki związek byłby wapnia, gdyby był w połączeniu z chlorem?
Za pomocą trójkąta wzajemności tlen jest wspólnym elementem dla dwóch związków. Masowe proporcje dwóch natlenionych związków są najpierw określone:
40G CA/16 GO = 5G CA/2G lub
71G Cl/16G lub
A teraz dzieląc dwie masowe proporcje Cao i Cl2Albo będziemy mieli:
(5G CA/2G O)/(71G Cl/16G O) = 80 g Ca/142G Cl = 40 g Ca/71G Cl
Zwróć uwagę, że prawo proporcji masowych jest spełnione: 40 g wapnia reakcja z 71 g chloru.
Tlenki siarki
Tlen i siarka reagują z miedzią, aby uzyskać odpowiednio miedź (CUO) i siarczek miedzi (CUS). Ile siarki zareagowałoby z tlenem?
W tlenku miedzi 63,5 g miedzi łączy się z 16 g tlenu. W siarczku miedzi 63,5 g miedzi łączy się przy 32 g siarki. Dzieląc masowe proporcje:
(63,5 g Cu/16G o)/(63,5 g cu/32 g s) = 2032 g S/1016G O = 2G S/1G lub
Masowa proporcja 2: 1 jest wielokrotnością 4 (63,5/16), która pokazuje, że prawo Richtera jest spełnione. Przy tej proporcji uzyskuje się tlenek siarki (32 g siarki reakcji z 16 g tlenu).
Jeśli ten odsetek zostanie podzielony przez dwa, będzie 1: 1. Znowu jest teraz 4 lub 2, a zatem jest tak2, Dwutlenek siarki (32 g siarki reagują z 32 g tlenu).
Może ci służyć: fucosa: Charakterystyka, struktura, funkcjeSiarczek i tlenek żelaza
Reakcja siarczku żelaza (FES), w którym 32 g siarki łączy się z 56 g żelaza, z tlenek żelazny (brzydki), w którym 16 g tlenu łączy się z 56 g żelaza. Ten element służy jako odniesienie.
W związkach FES i brzydkich reakcji siarka i tlen (O) w odniesieniu do żelaza (wiary) znajdują się proporcjonalnie 2: 1. W tlenku siarki (SO) 32 g siarki łączy się z 16 g tlenu, więc siarka i tlen występują w proporcji 2: 1.
Wskazuje to, że prawo wzajemnych proporcji lub prawa Richtera jest spełnione.
Można zastosować proporcję między siarką a tlenem w tlenku siarki (2: 1), aby obliczyć, ile tlenu reaguje z 15 g siarki.
o Tlen g = (15 g s) ∙ (1 g o/2 g s) = 7,5 g
Bibliografia
- Prawo wzajemnego proporcji: definicja i przykład. Badanie. Odzyskane z: Study.com
- Prawo wzajemnych proporcji. Chemia librettexts. Odzyskane z: chem.Librettexts.org

