Koncepcja izotermy adsorpcji, typy, przykłady

- 4122
- 38
- Marianna Czarnecki
Izotermy adsorpcyjne Są to graficzne reprezentacje zachowania zaadsorbowanej cząstki, na powierzchni stałej lub cieczy, gdy jej stężenie jest zwiększone. Jeśli zaadsorbowane cząstki odpowiadają cząstkom gazowym, wówczas uwzględniono jego ciśnienie.
Obserwując tę izotermię, można podjąć ideę procesu adsorpcji; I dlatego w jaki sposób interakcje cząsteczkowe i charakterystyki powierzchni. Analiza izotermy jest wywnioskowana, jeśli powierzchnia jest gładka, porowata lub mikroporowata, a także możliwe kondensacje.
 Komponenty niezbędne do wykresu lub konstrukcji izoterm adsorpcji. Źródło: Gabriel Bolívar.
Komponenty niezbędne do wykresu lub konstrukcji izoterm adsorpcji. Źródło: Gabriel Bolívar. Najwyższy obraz pomaga wyjaśnić wspomniane. Zaadsorbowane cząstki (fioletowe kółka) są adsorbatami SAM. Podczas gdy adsorbent jest tym, który ma obszar, na którym adsorbaty będą adsorbowane. Wraz ze wzrostem ciśnienia lub stężenia, tym większa zaadsorbowana objętość nad adsorbentem.
Ta prosta reprezentacja odpowiada adsorpcji opisanej przez izotermę typu I. Zastosowanie izoterm, adsorpcji gazów lub bezsensowności ciekłych na żelach, ciałach stałych lub katalizatorach.
[TOC]
Rodzaje izoterm adsorpcji
 Izotermy adsorpcyjne dla układów gazowych. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izotermy adsorpcyjne dla układów gazowych. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Pięć głównych izoterm eksperymentalnych zastosowanych przez S pokazano powyżej. Brunauer do klasyfikowania cząstek gazowych na ciałach stałych. Każdy opisuje inny proces adsorpcji. Ponadto każdy ma modele matematyczne, które mają na celu wywnioskowanie zachowania swoich krzywych.
Niezbędne, jakie są jednostki lub zmienne stosowane w osi x (p/po) i y (x), oś x wskazuje, ile ciśnienia lub konwersji adsorbatu „działa” na stałym; Podczas gdy oś.
Może ci służyć: siarczan miedzi (CUSO4): struktura, właściwości, uzyskiwanie, użyciaZatem, gdy poruszamy się w prawo od osi x, widzimy, w jaki sposób ilość zaadsorbowanych cząstek wzrasta w zależności od wzrostu ciśnienia lub stężeń. To prowadzi do maksimum, rozkładu, doliny itp., że w jakiś sposób pozwala interpretować sposób, w jaki ma miejsce adsorpcja.
Izoterm typu I
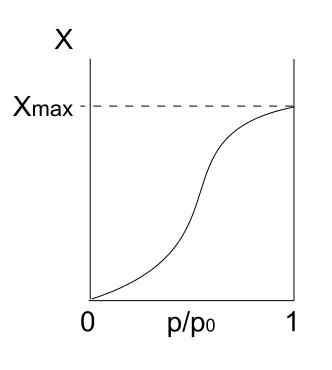
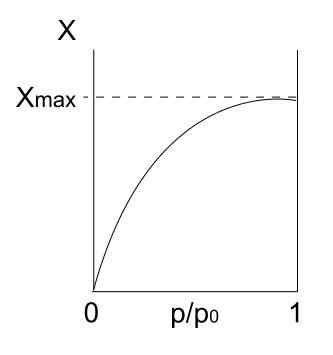 Izoterm typu I. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izoterm typu I. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Mamy powyższą izotermę typu I, która jest również znana jako izoterma Langmuir, ponieważ jego model przewidywał kształt tej krzywej. Widząc to, natychmiast interpretowane jest, że istnieje maksymalna ilość (xmax) cząstek adsorbowanych, które nie będą się różnić bez względu na to, jak bardzo wzrośnie ciśnienia.
Ta maksymalna wartość adsorpcji może wynikać z kilku powodów. Jednym z nich jest to, że dzieje się chemisorcja, co oznacza, że cząstki lub adsorbaty są silnie związane z powierzchnią stałego lub adsorbentu. Gdy na powierzchni nie będzie już miejsca, aby pomieścić więcej cząstek, nie będzie już adsorpcji.
Mówi się następnie, że utworzyła się monowarstka (takie jak fioletowe kręgi pierwszego obrazu).
Innym powodem uzasadnienia izotermy typu I jest to, że występuje fisisorpcja, co oznacza, że interakcje cząsteczkowe są bardzo słabe (nie oznaczają tworzenia wiązań chemicznych).
W takim przypadku cząstki wchodzą do mikroporosów, które po wypełnieniu powierzchnia nie będzie miał więcej miejsc na następujące adsorcje; Oznacza to, że ma niewielki obszar zewnętrzny (tak jakby była to bardzo drobna krata). To zachowanie obserwuje się, gdy analizowane są mikroporowate proszki.
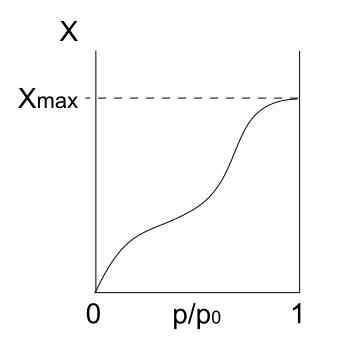
Może ci służyć: krzem: historia, właściwości, struktura, uzyskiwanie, użyciaWpisz izotermę Ii
 Izoterma typu II. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izoterma typu II. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) W górę mamy izotermę typu II, znaną również jako izoterma sigmoidalna. To opisuje procesy physis zarówno dla nieusowych substancji stałych, jak i makroporowatych ciał stałych.
Zauważ, że na początku przypomina poprzednią izotermę, co oznacza, że zaadsorbowane cząstki tworzą monowarstwę na powierzchni adsorbentu. Po przygotowaniu monowarstwy pozostałe cząstki będą adsorbowane na pierwszym miejscu, co daje powstanie wielowarstwowych. To wtedy widzimy charakterystyczny wzrost tej izotermy (po prawej).
Innym powodem, dla którego uzyskano izotermę typu II, jest to, że cząsteczki odczuwają większe powinowactwo do powierzchni niż siebie. Oznacza to, że monowarstwy (cząsteczki-superfic) będzie bardziej stabilne i trwałe niż wielowarstwowe (cząsteczki) później.
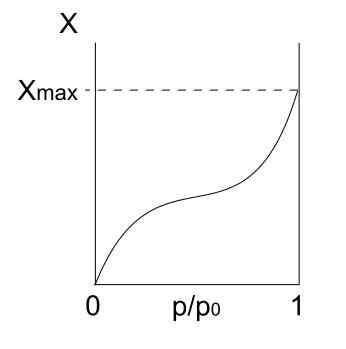
Wpisz izotermę Iii
 Izoterma typu III. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izoterma typu III. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Izoterma typu III jest podobna do typu II w odniesieniu do jego interpretacji: multicapas i physis. Jednak tym razem interakcje między multicapasami są silniejsze niż interakcje monowarstwy z powierzchnią stałego. Dlatego jest to nieregularna adsorpcja, z kopcami zaadsorbowanych cząstek i części wolnych powierzchniowych.
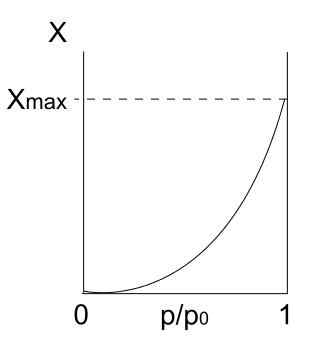
Wpisz izotermę Iv
 Izoterma typu IV. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izoterma typu IV. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Izoterma typu IV opisuje również procesy Fisisorption i wielowarstwowe, wyglądające jak izoterma typu II; Ale teraz, w porowatych (i mezoporowatych) ciałach, w których kondensacja cząstek gazowych jest możliwa w małych objętościach cieczy. Dopóki pory z płynem nie zostanie „pokryte”, monowarstw.
Może ci podać: chemia żywności: pole studiów, elementy, zastosowaniaWpisz izotermę V
 Izoterm typu V. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0)
Izoterm typu V. Źródło: Daniele Pugliesi/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Izoterma typu V jest podobna do typu IV, tylko tym razem formacje multicapów są bardziej podatne niż odpowiednie mono forpa. To znaczy przypomina adsorpcję opisaną przez izotermę typu III. Tutaj multicapa osiąga maksymalną grubość, w której nie ma miejsca na więcej cząstek do adsorb.
Przykłady
Niektóre przykłady układów gazowych zostaną wymienione poniżej obok rodzaju izoterm, które zostały uzyskane w ich badaniach eksperymentalnych:
-Węgiel amoniak (typ I)
-Azot-Zeolity (typ I)
-Węgiel wodorowy w wysokich temperaturach (typ I)
-Węgiel tlen-negro (typ I)
-Azot krzemionkowy (typ II)
-Azot-hierro (typ II)
-Krzemionka bromo-żel (typ III)
-Para jodu krzemionkowego (typ III)
-Azot-polityczny (typ III)
-Kripton-Negro z węgla (typ IV)
--Gel benzenowy tlenku żelaza (typ IV)
-Węgiel pary wodnej (typ V)
Należy zauważyć, że wspomnianymi ciałami stałymi były węgiel, czarny węgiel, żelazo metaliczne, tlenek żelaza, zeolity i żel krzemionkowy. Wszystkie są dobrymi przykładami adsorbentów o różnych zastosowaniach przemysłowych.
Bibliografia
- Walter J. Moore. (1963). Chemia fizyczna. W termodynamice i równowadze chemicznej. (Czwarty ed.). Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja, strona 479-540. MC Graw Hill.
- Glasstone. (1970). Podręcznik chemii fizycznej. Druga edycja. D. Van Nostrand, Company, Inc.
- Rozdział 3. Zjawiska powierzchniowe. (S.F.). Adsorpcja. [PDF]. Odzyskane z: depa.Fquim.Unam.MX
- Lowell s., Shields J.I. (1984) izotermy adsorpcyjne. W: powierzchnia proszku i porowatość. Springer, Dordrecht.
- Elsevier b.V. (2020). Izoterma adsorpcji. Scientedirect. Pobrano z: Scientedirect.com
- Wikipedia. (2020). Adsorpcja. Źródło: w:.Wikipedia.org

