Struktura wodorotlenku niklu (III), właściwości, zastosowania, ryzyko
- 4202
- 639
- Filip Augustyn
On Wodorotlenek niklu (III) Jest to związek nieorganiczny, w którym metal niklu ma liczbę utleniania 3+. Jego formuła chemiczna to Ni (OH)3. Według konsultowanych źródeł do tej pory nie było możliwe weryfikację istnienia wodorotlenku niklu (III) lub (OH)3, Ale Nickel Oxo-hydroksyd (III), dziecko (OH) uzyskano.
Nickel (III) Nio (OH) oksohydroksyd to czarna krystaliczna substancja stała, która krystalizuje na dwa sposoby: kształt beta i gamma. Najczęstszą postacią krystaliczną (OH) jest beta.
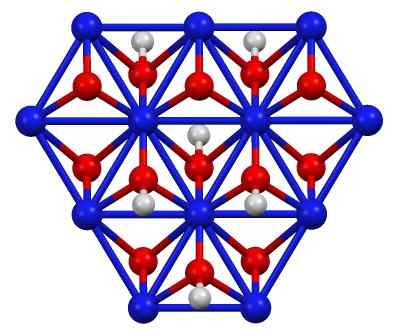
 Struktura niklu oksohydroksydowego (III), dziecko (OH). Niebieski = nikiel, czerwony = tlen, biały = wodór. Autor: Smokefoot. Źródło: własna praca. Źródło: Wikipedia Commons
Struktura niklu oksohydroksydowego (III), dziecko (OH). Niebieski = nikiel, czerwony = tlen, biały = wodór. Autor: Smokefoot. Źródło: własna praca. Źródło: Wikipedia Commons Dziecko (OH) można uzyskać przez utlenianie roztworów azotanowych niklu (II) (lub (nie3)2) z chlorem (CL2) lub brom (BR2) W obecności wodorotlenku potasu (KOH). Nickel (III) oksohydroksyd jest bardzo rozpuszczalny w kwasach. Ma zastosowanie w bateriach niklu w Superca.
Nikiel (III) Nio (OH) i wodorotlenek niklu (II) lub (OH) (OH)2 Są zjednoczeni w ramach większości swoich zastosowań, ponieważ oba są częścią tego samego równania redukcji tlenku.
Będąc niklu, dziecko (OH) przedstawia takie same ryzyko innych soli niklu, czyli podrażnienie skóry lub zapalenie skóry i raka.
[TOC]
Struktura krystaliczna
Niklu oksohydroksyd (III) krystalizuje się na dwa sposoby: beta i gamma. Forma beta β-nio (OH) ma strukturę bardzo podobną do β-ni (OH)2, co wydaje się logiczne, ponieważ pierwszy pochodzi z utleniania tego ostatniego.
Forma gamma γ-nio (OH) jest produktem utleniania wodorotlenku niklu (II) w postaci alfa, α-ni (OH)2. Podobnie jak ten ostatni, gamma ma strukturę warstwową z alkalicznymi jonami metali, anions i woda przeplatane między warstwami.
Elektroniczna Konfiguracja
U dziecka (OH) nikiel znajduje się w stanie utleniania 3+, co oznacza, że brakuje 3 elektronów na jego najbardziej zewnętrznych warstwach, to znaczy brakuje dwóch elektronów warstwy 4S i elektron z warstwy 3D. Konfiguracja elektroniczna Ni3+ U dziecka (OH) to: [AR] 3D7, Gdzie [AR] jest elektroniczną konfiguracją szlachetnego gazu argonowego.
Może ci służyć: PI LinkNomenklatura
- Nio (OH): Nickel Oxohydroksyd (III)
- Nikiel Black
Nieruchomości
Stan fizyczny
Czarna krystaliczna stała.
Rozpuszczalność
Nio (OH) oksohydroksyd jest bardzo rozpuszczalny w kwasach. Faza gamma rozpuszcza się w kwasie siarkowym z ewolucją tlenu.
Inne właściwości
W gorącej wodzie staje się oksohydroksydem niklu (II) i (iii), lub3ALBO2(OH)4.
Rozkłada się do 140 ° C w niklu (II) (tlenek dziecka i tlenu.
Fazę gamma (γ-nio (OH)) można uzyskać na przykład na kilka sposobów, lecząc nikiel stopioną mieszaniną nadtlenku sodu (Na (Na2ALBO2) i wodorotlenek sodu (NaOH) w temperaturze 600 ° C i chłodzenie w wodzie lodowej.
Faza gamma rozpada się po podgrzaniu do 138 ° C.
Aplikacje
W bateriach niklu
Nickel-hydrum bateria Edisona, w której KOH jest stosowany jako elektrolit, opiera się na reakcji oksohydroksydowej niklu (III) z żelazem:
Pobierać:
Fe + 2nio (OH) + H2Lub ⇔ Wiara (OH)2 + 2ni (OH)2
Ciężar:
Jest to odwracalna reakcja redukcji tlenku.
W anodie tych akumulatorów występuje seria procesów chemicznych i elektrochemicznych. Poniżej znajduje się ogólny program:
Pobierać
β-Ni (OH)2 ⇔ β-nio (OH) + H+ + I-
Ciężar
Starzenie się ↑ ↓ przeciążenie
Pobierać
α-Ni (OH)2 ⇔ γ-nio (OH) + H+ + I-
Ciężar
Może ci służyć: arsen: historia, struktura, właściwości, użyciaW technologii akumulatorów niklu niklu oksohydroksyd (III) Nio (OH) nazywa się „Masą aktywną niklu”.
 Baterie do ładowania niklu. Autor: Superusergeneric. Źródło: własna praca. Źródło: Wikipedia Commons.
Baterie do ładowania niklu. Autor: Superusergeneric. Źródło: własna praca. Źródło: Wikipedia Commons. W elektrokatalizy jako katalizator regeneracyjny
Dziecko (OH) zostało z powodzeniem wykorzystane w elektrosyntezie azopirazoli, poprzez elektrokatalityczne utlenianie aminopirazoli. Udowodniono również jego przydatność w syntezie kwasów karboksylowych zaczynających się od alkoholi lub związków karbonylowych.
 Uzyskanie kwasu karboksylowego przez utlenianie alkoholu katalizowanego przez dziecko (OH). Źródło: pierwotnie z In.Wikipedia. Oryginalny autora przesyłający był v8rik w IN.Wikipedia. Źródło: Wikipedia Commons
Uzyskanie kwasu karboksylowego przez utlenianie alkoholu katalizowanego przez dziecko (OH). Źródło: pierwotnie z In.Wikipedia. Oryginalny autora przesyłający był v8rik w IN.Wikipedia. Źródło: Wikipedia Commons Innym przykładem jest ilościowa konwersja hydroksymetypirydyny do kwasu pirydokarboksylowego. W takim przypadku elektroda stalowa lub niklu odpowiadająca anodzie jest pokryta warstwą dziecka (OH). Medium, w którym wykonywana jest elektroliza, jest alkaliczna.
W tych reakcjach dziecko (OH) działa jako mediator z redukcji lub mediator „redoks”.
Elektroliza przeprowadza się w komórce z anodą niklu i katodą tytanową, w pożywce alkalicznej. Podczas procesu jest tworzone lub (OH)2 Na powierzchni anody niklu, która jest szybko utleniona do dziecka (OH):
Ni (oh)2 + Oh- - I- ⇔ Nio (OH) + H2ALBO
Dziecko (OH) reaguje z podłożem organicznym i uzyskuje się pożądany produkt organiczny, regenerując Ni (OH)2:
Nio (OH) + związek organiczny → Ni (OH)2 + produkt
Kiedy Ni (OH) regeneruje się2, Reakcja katalizy trwa.
Zastosowanie dziecka (OH) jako elektrokatyzatora pozwala uzyskać związki organiczne o niskich kosztach i w sposób przyjazny dla środowiska.
U super karty
Dziecko (OH) razem z Ni (OH)2 Stanowią doskonałe materiały do supercaiding elektrod (angielski Supercapacitos).
Ni (oh)2 + Oh- ⇔ Nio (OH) + H2Lub + e-
Mają wysoką pojemność, niski koszt i, zgodnie z niektórymi odniesieniami, pod wpływem środowiska.
 Skraplacze w obwodzie elektronicznym. Autor: PDPHOTOS. Źródło: Pixabay.
Skraplacze w obwodzie elektronicznym. Autor: PDPHOTOS. Źródło: Pixabay. Mają jednak niską przewodność. Rozwiązuje się to za pomocą nanocząstek wspomnianych związków, ponieważ w ten sposób zwiększa powierzchnię i zmniejsza odległość wymaganą do dyfuzji, co zapewnia dużą prędkość przenoszenia elektronów i/lub jonów.
Może ci służyć: elastyczne materiałyW utlenianiu jonów metali
Jedno z komercyjnych zastosowań oksohydroksydowych niklu (III) opiera się na jego zdolności do utleniania jonów kobaltowych (II) w roztworze jonów kobaltowych (III).
Ryzyko
W roztworze nikiel jest bardziej stabilny jak jon lub2+, Dlatego nie jest zwykle kontaktowe z NI3+. Jednak środki ostrożności są takie same, ponieważ nikiel, niezależnie od tego, czy metaliczny, w roztworze, czy w postaci swoich soli, może powodować uczulenie skóry.
Wskazane jest użycie sprzętu ochronnego i odzieży, takich jak tarcza twarzy, rękawiczki i buty bezpieczeństwa. Wszystko to musi być używane za każdym razem, gdy istnieje możliwość kontaktu z rozwiązaniami Nickel.
Jeśli wystąpi zapalenie skóry, należy leczyć lekarzem, aby wykluczyć, że jest to spowodowane nikiel.
Jeśli chodzi o możliwość wdychania, jest to dobra praktyka.
Wszystkie związki niklu są klasyfikowane przez Międzynarodową Agencję Badań Raka lub IARC (akronim dla angielskiego Międzynarodowa Agencja Badań nad Rakiem), w kategorii rakotwórczych dla ludzi.
Opiera się to na danych epidemiologicznych i eksperymentalnych.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Lyalin, ur.V. i in. Elektrosynteza azopirazoli poprzez utlenianie N-alkiloaminopyrazoli na anodzie dziecka (OH) w wodnej alkali-zielonej metodzie dla Homouple N-N. Listy tetrahedronowe. 59 (2018) 2741-2744. Odzyskane z naukowym.com.
- Liuyang, Zhang i in. (2018). Materiały na bazie niklu na superkapacytos. Materiały dzisiaj. Odzyskane z naukowym.com
- Ettel, v.DO. i Mosolu, m. DO. (1977). Przygotowanie niklu czarnego. LUB.S. Patent nr. 4 006,216. 1 lutego 1977.
- Scharbert, ur. (1993). Proces utleniania pochodnych hydroksymetylopirydyny do pochodnych kwasu pirydynoszczelowego w anodach wodorotlenku tlenku niklu. LUB.S. Patent nr. 5 259 933. 9 listopada 1993.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 17. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom w 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Hydroksydki niklu. W podręczniku materiałów akumulatorowych. VCH Publisher. Wyzdrowiał z Osti.Gov.
- « Historia makrokomputerów, cechy, zastosowania, przykłady
- Wyposażone komputery analogowe, komponenty, typy »

