Struktura wodorotlenku chromu, właściwości, synteza,
- 719
- 164
- Marianna Czarnecki
On Wodorotlenek chromu Jest to nieorganiczny produkt złożony reakcji podstawy z chromowaną solą. Jego wzór chemiczny zmienia się w zależności od stanu utleniania chromu (+2 lub +3, dla tego rodzaju związku). Tak więc posiadanie Cr (OH)2 Dla wodorotlenku chromu (II) i Cr (OH)3 W przypadku wodorotlenku chromu (III).
Z powodów elektronicznych CR2+ jest bardziej niestabilny niż CR3+, Więc cr (oh)2 Jest to środek redukujący (traci elektron do przeniesienia do +3). Zatem, chociaż oba wodorotlenki można uzyskać jako osady, Cr (OH)3 -Nazywany także wodorotlenkiem chromu- jest dominującym związkiem.
 Wygląd wodorotlenku chromu
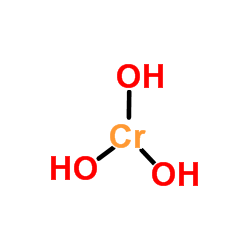
Wygląd wodorotlenku chromu W przeciwieństwie do tych wodorotlenków uzyskanych przez proste rozpuszczanie tlenków metali w wodzie, Cr (OH)3 Nie jest syntetyzowana tą drogą ze względu na słabą rozpuszczalność tlenku chromu (Cr2ALBO3, górny obraz). Jednak Cr (OH)3 Jest uważany za CR2ALBO3· Xh2Lub, używane jako szmaragdowy zielony pigment (Guinet Green).
W laboratorium opiera się na metalicznym chromie, który jest rozpuszczony w roztworze kwasowym w celu tworzenia kompleksu [Cr (OH2)6]3+. Ten wodny kompleks reaguje następnie z podstawą (NaOH lub KOH), tworząc odpowiedni wodorotlenek chromu.
Jeśli poprzednie kroki są przeprowadzane w warunkach, które zapewniają brak tlenu, reakcja powstaje Cr (OH)2 (Chromous Wodorotlenek). Następnie wymagane jest rozdzielenie i odwodnienie stałego osadu. W rezultacie prawdziwy CR (OH) jest „urodzony”3, Zielony proszek z polimerową i niepewną strukturą.
[TOC]
Struktura wodorotlenku chromu
Górny obraz jest najprostszą reprezentacją CR (OH)3 w gazie i izolowanej fazie. Także i zakładając, że czysto jonowy charakter jego interakcji, w kationach stałych można wizualizować3+ interakcja z trzykrotną ilością anionów OH-.
Może ci służyć: pochłanianie trzonoweJednak charakter łącza CR-OH jest bardziej kowalencyjny, ze względu na chemię koordynacji CR3+.
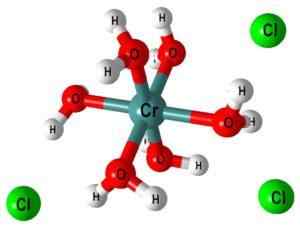
Na przykład kompleks [Cr (OH2)6]3+ Wskazuje, że metaliczne centrum chromu jest skoordynowane z sześcioma cząsteczkami wody; Ponieważ są one neutralne, kompleks wykazuje dodatnie obciążenie oryginalnego kationu, Cr,3+.
Oktaedron i polimeryzacja
Na górnym obrazie struktura kompleksu [Cr (OH jest reprezentowany2)6]3+. Jony CL- Mogą pochodzić na przykład z kwasu solnego w przypadku zastosowania go do rozpuszczania soli lub tlenku chromu.
Gdy do pożywki reakcyjnej dodaje się NaOH (lub koh), jon OH- UNS jest cząsteczką tego kompleksu, tworząc [Cr (OH2)5(Oh)]2+ (Teraz jest pięć cząsteczek wody, ponieważ szósty stracił proton).
Kolejnie ten nowy kompleks odwadniany do innego wodnego kompleksu, tworząc dímeros zjednoczonych przez mosty wodorotlenkowe:
(H2ALBO)5Cr-oh-cr (och2)5
Wraz ze wzrostem podstawy pożywki (pH wznosi się) kompleks [Cr (OH2)4(OH)2]+, a także zwiększyć prawdopodobieństwo nowych mostów wodorotlenkowych w celu tworzenia galaretek -polimerów. W rzeczywistości ta „galaretka szarej” odmawia wytrącania uporządkowanego.
Wreszcie Cr (och2)3(OH)3 Składa się z oktaedronu z CR3+ W środku i powiązane z trzema cząsteczkami wody i trzema OH- które zneutralizują ich ładunek dodatni; To bez rozważania polimeryzacji.
Kiedy CR (och2)3(OH)3 Jest odwodniony, skoordynowana woda z CR jest eliminowana3+, A ponieważ kation ten jest skoordynowany z sześcioma gatunkami (ligandami), powstają struktury polimerowe, w których zaangażowane są powiązania CR-CR.
Może ci służyć: tłuszcz butyczny: pozyskiwanie, typy, skład, zastosowania, korzyściPonadto, gdy jest odwodniony, jego strukturę można uznać za typ CR2ALBO3· 3H2ALBO; Innymi słowy, trójhydowany tlenek chromowy. Jednak są to badania fizykochemiczne ciała stałego, które mogą rzucić światło na prawdziwą strukturę Cr (OH)3 w tym punkcie.
Właściwości fizyczne i chemiczne wodorotlenku chromu
CR (OH)3 Wygląda jak niebiesko-zielony proszek, ale jeśli chodzi o kontakt z wodą, tworzy szarawo zieloną galaretkę.
Jest nierozpuszczalny w wodzie, ale rozpuszczalny w kwasach i silnych zasadach. Ponadto, gdy jest podgrzewany, rozkłada się, wytwarzając pary tlenku chromu.
Anfoteryzm
Dlaczego chrom wodorotlenku jest rozpuszczalny w roztworach kwasowych i podstawowych? Przyczyną jest jego charakter Amphotera, który pozwala reakcji z zarówno kwasami, jak i podstawami. Ta właściwość jest charakterystyczna dla CR3+.
Podczas reakcji z kwasami, Cr (OH2)3(OH)3 Rozpuszcza się, ponieważ mosty hydroksylowe są zepsute, odpowiedzialne za galaretkę osadu.
Z drugiej strony, gdy dodaje się więcej bazy, oh- Nadal zastępują cząsteczki wody, tworząc kompleks ujemny [Cr (OH2)2(OH)4]-. Ten kompleks obraca roztwór jasnozielonego koloru, który nasila się w miarę trwania reakcji.
Kiedy cała cr (och2)3(OH)3 Zareagowałeś, jeden ostatni kompleks uzyskuje się, jak wskazano w równaniu chemicznym:
CR (och2)3(OH)3 + 3 Och- [Cr (OH)6] 3- + 3 godz2ALBO
Ten ujemny kompleks jest związany z otaczającymi kationami (na+, Jeśli podstawa jest naoh) i po odparowaniu wody, soli chromito sodu (Nacro2, Szmaragdowy zielony kolor). Zatem zarówno kwas, jak i podkład podstawowy są w stanie rozpuścić wodorotlenek chromu.
Może ci służyć: IndianinSynteza wodorotlenku chromu w dziedzinie przemysłowej
W przemyśle jest wytwarzany przez opady siarczanu chromu za pomocą roztworów wodorotlenku sodu lub wodorotlenku. Podobnie, wodorotlenek chromu jest wytwarzany przez schematyzowaną reakcję:
Cro72- + 3 SO2 + 2h+ => 2 cr3+ + 3 SO42- + H2ALBO
Cr3+ + 3oh- => Cr (OH)3
Jak pokazano w poprzedniej procedurze, redukcja Chrome VI do Chrome III ma ogromne znaczenie ekologiczne.
Chrom III jest stosunkowo nieszkodliwy dla bioty, podczas gdy chrom VI jest toksyczny i rakotwórczy, oprócz bardzo rozpuszczalnego, więc jego eliminacja środowiska jest ważna.
Technologia oczyszczania wody i gleby obejmuje zmniejszenie z CR (VI) do CR (III).
Aplikacje
Wodorotlenek chromu ma różne zastosowania:
- Sformułowanie makijażu.
- Farby do włosów.
- Lakier do paznokci.
- Produkty do pielęgnacji skóry.
- Produkty czyszczące.
- W metalowym wykończeniu, które stanowi 73 % jego zużycia w branży.
- W zachowaniu drewna.
Bibliografia
- Whitten, Davis, Peck i Stanley. Chemia. (8 wyd.). Cengage Learning, s. 873, 874.
- Pubchem. Wodorotlenek chromowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov
- Synteza, charakterystyka i stabilność wodorotlenków Cr (III) i Fe (III). Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, e. i Antypas, G. J. Hazard Mater. 264: 490-497.
- PREBCHEM. Przygotowanie chromu (III) wodorotlenku. Odzyskane z PrepChem.com
- Wikipedia. (2018). Chrom (III) wodorotlenek. Odzyskane z.Wikipedia.org