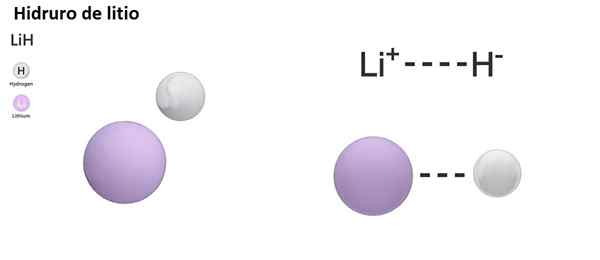Hydrory
- 1461
- 440
- Pani Waleria Marek
Co to są hydruros?
Hydros to związki chemiczne wynikające z reakcji wodoru z pierwiastkami metali (sód, potas, wapń itp.), a nie metale (chlor, fluor, tlen, azot, węgiel itp.). Wodór reaguje z prawie wszystkimi elementami chemicznymi, więc hydrory są bardzo różnorodnymi substancjami.
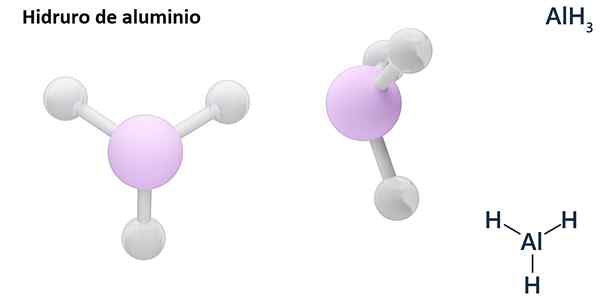
Jego ogólne formuły mogą być typem MHN, Gdzie m jest metalowym i N jej walencja (+1, +2, +3), takie jak wodorek aluminiowy, ALH3; lub typu EHN lub hNI gdzie E jest elementem niemetalicznym i N Jego Walencja, jak NH3 lub h2S.
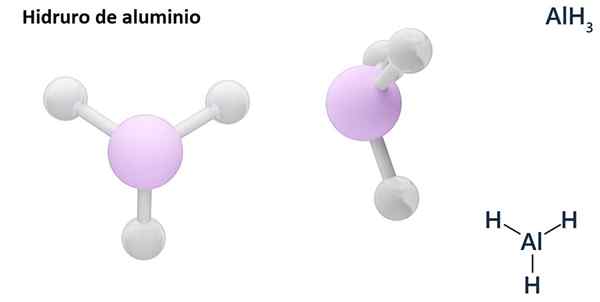
Hydros są zwykle związkami binarnymi, to znaczy wynikają z kombinacji wodoru z innym elementem chemicznym. Jednak wodór może również tworzyć kombinacje z kilkoma pierwiastkami chemicznymi, tworząc bardziej złożone hydrory. Wszystkie wyjaśnione hydrory będą binarne, takie jak ALH3 i nie.
Istnieją trzy rodzaje hydrorów zgodnie z naturą jego wiązania chemicznego: jonowe, molekularne i metaliczne. Hydrory jonowe lub soli fizjologiczne charakteryzują się obecnością wiązania jonowego. Ten link składa się z przyciągania elektrycznego między dodatnim obciążeniem metalu alkalicznego (na+) lub alkaliczna mieszanka (Mg2+) i ujemne obciążenie anionu wodorotu (h-).
Z drugiej strony wodorki molekularne charakteryzują się tworzeniem kowalencyjnego wiązania między wodorem a elementem niemetalicznym. Wśród elementów niemetalicznych, które tworzą hydros, są: chlor, brom, fluor, jod, tlen i azot.
A hydrory metali wynikają z kombinacji wodoru z niektórymi metalami przejściowymi. Ten rodzaj wodorków, w przeciwieństwie do poprzednich, ma złożone struktury i nie zostaną tutaj wyjaśnione.
Właściwości hydros
Właściwości hydrurów różnią się w zależności od rodzaju wodorku: jonowe, molekularne lub metaliczne, więc ich właściwości muszą być wskazane osobno.
Hydrory jonowe lub soli fizjologiczne
Są to krystaliczne białe substancje stałe, ale ze względu na obecność zanieczyszczeń zdobywają szarawy kolor. Wodorki te nie są rozpuszczalne w wspólnych rozpuszczalnikach, takich jak woda, alkohol itp. Mają też wysokie punkty gotowania i fuzji.
Mają wysoką i stopioną gęstość stanu może prowadzić energię elektryczną.
Hydurnie jonowe są uważane za podstawowe lub alkaliczne, ponieważ rozpuszczone w wodorotlenkach i uwalnianie wodoru molekularnego:
Nah +h2O → h2 + Naoh
Reakcja wodorku jonowego z wodą jest bardzo energiczna i niebezpieczna: wytwarza wodór w postaci gazowej, który jest materiałem palnym i łatwopalnym.
Hydurny jonowe mogą również reagować z halogenkami metali, utworzonymi przez metal i nie -metal znany jako halogen (MX, X = F, Cl, Br, I):
Może ci służyć: dimetyloinę: struktura, właściwości, synteza, zastosowania4 lih +alcl3 → lialh4 + 3 LICL
LIH (wodorot litowy) jest związkiem binarnym; podczas gdy lialh4 (Lit i wodorek aluminiowy) to związek trójskładnikowy, to znaczy składa się z trzech elementów chemicznych.
Hydros molekularny lub kowalencyjny
Są w stanie ciekłym lub gazowym, w przeciwieństwie do hydrorów jonowych, które są stałe. Mają niskie punkty gotowania i fuzji, obserwując, że zwiększając masę cząsteczkową wodorku, temperatura wrzenia wzrasta; Z wyjątkiem amoniaku (NH3), Woda (h2O) i wodorek fluorkowy (HF).
Kowalencyjne wodorki to słabe przewody energii elektrycznej, a wiele z ich właściwości wynika z tworzenia mostów wodorowych. Kowalencyjne wodorki są uważane za kwasy, ponieważ rozpuszczone w wodzie mogą powodować kwasy, na przykład.
Hydrory metalu
Są w stanie stałym, przedstawiając ciemny ton metali. Są dobrymi przewodnikami energii elektrycznej i mają błyszczące powierzchnie. Metalowe wodorki, które są stabilne w powietrzu, stają się odczynnikami, gdy się ogrzewają, na przykład wodorkiem uranu (UH3) Przedstaw tę właściwość.
Nomenklatura
Sposób nazwania hydrorów jest prosty i nie różni się zbytnio w żadnej z nomenklatury. Jeśli metaliczny metal lub element ma więcej niż jedną walencję, jest on określony w nawiasach i z liczbą rzymską zgodnie z nomenklaturą zapasową.
Na przykład FEH3 nazywa się wodorkiem żelaza (iii) i coh2 Kobalt Hydro (II). Te same wodorki można również wyznaczyć za pomocą systematycznej nomenklatury, która wykorzystuje liczby greckie (DI, Tri, Tetra itp.). Tak więc Feh3 nazywa się żelaznym trójstronem i coh2 Cobalt dihydruro.
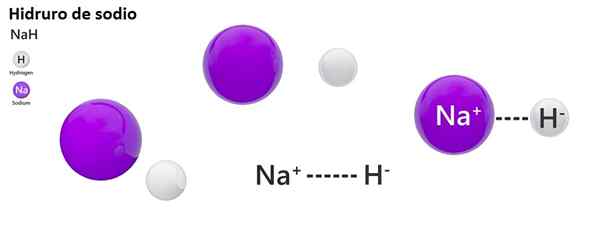
Klasyczna nomenklatura nie jest szeroko stosowana do hydros. Na przykład NaH jest znany bardziej jako wodorek sodu, a nie wodorek sodu.
 Wodorek sodu
Wodorek sodu Jak powstają hydros?
Hydrory jonowe lub soli fizjologiczne
Powstają one przez reakcję wodoru z metalem należącym do grupy metali alkalicznych lub grupy metali alkalicznych-terrero.
W hydrorach trenowanych z tymi metaliami wodór występuje w postaci H-, Znany jako anion wodny.
Metale alkaliczne (lit, sód, potas, rubidium i cez) reagują z wodorem, tworząc odpowiednie hydurns:
2 m (l)+h2(g) → 2 MH (s)
Może Ci służyć: Operacje jednostkoweMetal M podczas reakcji jest w stanie ciekłym, a wodór w stanie gazowym, więc reakcja wymaga wysokich temperatur i wysokich ciśnień. Rozważ następujący przykład:
2 li (l) +h2 (g) → 2 lih (s)
Reakcja wodoru z metaliami trzeciej alkalicznej (beryl, magnez, wapń, stront i bar), do tworzenia wodorku, jest podobna do obserwowanej w przypadku metali alkalicznych.
Magnez i berylu tworzą wodorki, ale ich wiązania z wodorem są typu kowalencyjnego; To znaczy, nie -joonic, w przeciwieństwie do innych metali alkalicznych:
CA (L) +H2 (g) → Cah2 (S)
Hydrory molekularne
Wodór może reagować z niemetaliami, odpowiadającymi grupom 14, 15, 16 i 17 stoliku okresowego, tworząc hydrory molekularne. Rozważmy na przykład tworzenie wodorku fluoru przez kombinację lub bezpośrednią mieszaninę wodoru z fluorem:
H2 (g) +f2 (g) → 2 hf (g)
HF jest znany bardziej jako fluor wodorowy, ale nazywany jest również wodorkiem fluoru.
Również wodór może reagować z tlenem (grupa 16 tabeli okresowej) zgodnie z tym samym schematem:
2 godz2 (g) +lub2 (g) → 2 h2O (g)
Reakcja wymaga podaży ciepła do wytwarzania tlenku wodoru (woda) lub wodorkiem tlenu.
Również wodór może reagować z azotem, należącym do grupy 15 tabeli okresowej z wytworzeniem wodorku azotu, lepiej znanego jako amoniak (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (G)
Reakcja wymaga dopływu ciepła, wysokiego ciśnienia i obecności katalizatorów (przyspieszają reakcje chemiczne).
Hydrory metalu
Są one tworzone przez reakcję metali przejściowych (grupy 3, 4, 5, 6, 10, 11 i 12 tabeli okresowej) z wodorem. Jednak metale przejściowe w grupach 7, 8 i 9 nie tworzą związków z wodorem, zjawisko znane jako szczelina wodordu lub wodorek szczeliny.
Unikalną cechą hydrorów metali przejściowych jest to, że nie zawsze przedstawiają one stały odsetek między liczbą atomów wodoru a liczbą atomów obecnych w wodorku. To znaczy, ich wzory i struktury nie są proste do reprezentowania.
Używa/zastosowania hydrosu
 Hydros są bardzo obecne w jednym z wielu rodzajów baterii: jak NIMH. Źródło: Multicherry, CC BY-SA 4.0, Via Wikimedia Commons
Hydros są bardzo obecne w jednym z wielu rodzajów baterii: jak NIMH. Źródło: Multicherry, CC BY-SA 4.0, Via Wikimedia Commons Hydros są obecne w niklu metalowych akumulatorów (NIMH), stosowanych wspólnie z metali ziem rzadkich, kobaltu lub manganu. Zbadano kilka hydrorów metali pod kątem stosowania w samochodach elektrycznych napędzanych przez komórki związane z wodorem.
Może Ci służyć: Redox Bilans Metoda: kroki, przykłady, ćwiczeniaŚrodki redukujące
Wodorek litowy i bor sodu (NABH4) Są stosowane jako reakcje chemiczne w reakcjach syntezy organicznej.
Magazynowanie wodoru i inne powiązane zastosowania
Istnieją piloty zużycia wodoru jako paliwa w pojazdach silnikowych, ale ze względu. Zastosowanie hydros zostało zaproponowane jako forma magazynowania wodoru, aby kontrolować ich niebezpieczeństwo.
Ponadto do oczyszczania i oddzielenia czujników wodoru i temperatury zastosowano hydrory.
Duszniki
Wodork wapnia służy do usuwania wody obecnej w rozpuszczalnikach organicznych.
Kwasy powstały z hydrorów molekularnych
Na przykład: kwas solny powstaje przez roztwór w wodnej pożywce wodorku chloru (HCL), przy użyciu kwasu chlorowodorowego w eliminacji tlenków pokrywających żelazo, zakwaszenie studni olejowych, wytwarzanie chlorku wapnia i obróbki mineralnej.
Nawozy
Amoniak (NH3) Jest to wodorek stosowany jako nawóz ciekłego i służy do syntezy związków z azotanem amonu i siarczanu amonu, które są stosowane jako nawozy.
Woda
Jest najważniejszym wodorkiem. Jest używany w wielu branżach z różnymi zastosowaniami i aplikacjami. Woda jest głównym odpowiedzialnym za istnienie żywych istot.
Przykłady hydrorów
Wreszcie, inne przykłady hydrów zostaną wymienione z ich odpowiednimi formułami i nazwami:
SNH4: Wodorek cyny | PH3: wodorek fosforu (fosfina) lub fosforu trójdroczny |
KH: Wodorek ołowiu | MGH2: Wodorek magnezu lub dihydruro magnezu |
KH: Wodorek potasu | CH4: CarRuro Carrruro lub tetrahydryd węglowy (metan) |
CAH2: Wodorek wapnia | FEH2: Wodoom żelaza (ii) |
Nah: wodorek sodu | ZNH2: Wodoodpak cynku |
LIH: Wodorek litowy | BAH2: Wodorek barowy |
CSH: Wodorek cezu | BH3: Bor Hydro (Bas |
Beh2: Beryl lub beryl dihydrid | SIH4: Hydro krzemowy (Silan) |
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wojes, Ryan. (27 sierpnia 2020). Co to jest wodorek metalu? Odzyskane z: Thoughtco.com
- Elementy amerykańskie. (2020). Wodożydy. Pobrano z: Americlements.com
- Wikipedia. (2020). Wodorot. Źródło: w:.Wikipedia.org
- Tandis arani. (15 sierpnia 2020). Wodożydy. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Redaktorzy Enyclopaedia Britannica. (2020). Wodorot. Odzyskane z: Britannica.com