Charakterystyka hemoolisyny, typy, mechanizmy działania
- 2867
- 620
- Filip Augustyn
Hemoolisine Jest to małe białko, które powoduje pory w błonie komórkowej erytrocytów i niektórych innych komórkach krwi ssaków. Jest ogólnie zsyntetyzowany i wydalany przez bakterie patogenne.
To białko jest jedną z najczęstszych toksyn drobnoustrojów i najlepiej zbadano. Czasami może powodować niedokrwistość hemolityczną, ponieważ ilość kanałów, przez które wychodzi wnętrze komórkowe, może nawet powodować lizę komórek.
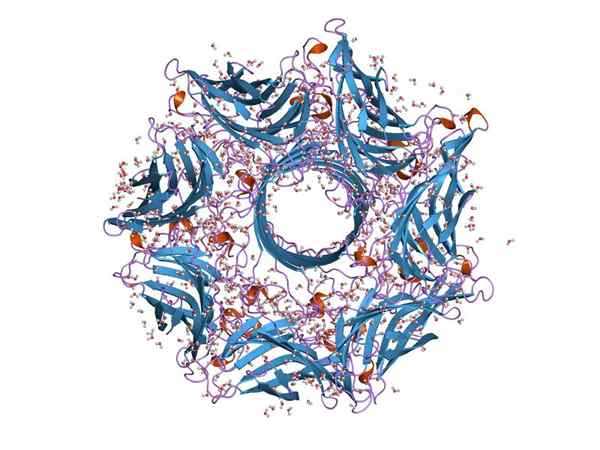
 Struktura molekularna hemoolisiny (źródło: Jawahar Swaminathan i personel MSD w Europejskim Instytucie Bioinformatycznym [domena publiczna] za pośrednictwem Wikimedia Commons)
Struktura molekularna hemoolisiny (źródło: Jawahar Swaminathan i personel MSD w Europejskim Instytucie Bioinformatycznym [domena publiczna] za pośrednictwem Wikimedia Commons) Zasadniczo hemoolisyna jest typową toksyną gatunku Paciorkowiec przewodu jelitowego. Jego funkcja umożliwia bakteriom przełamanie bariery nabłonkowej przewodu jelitowego, a tym samym poruszanie się przez krew, aby kolonizować inne tkanki.
Najczęstszym sposobem, w jaki hemoolisina występuje w naturze, jest postać α-hemolzyny. To białko jest jednym z najważniejszych czynników wirulencji większości szczepów Escherichia coli I niektóre Clostride.
Większość infekcji dróg moczowych jest spowodowana odmianami Escherichia coli które wytwarzają α-hemolzynę o cechach hemolitycznych.
Produkcja hemoolisyny i bakteriocyny była związana ze szczepami bakteryjnymi z mechanizmem kompetencji wobec innych gatunków, a produkcja obu toksyn wydaje się zależeć od tych samych determinantów genetycznych w genomie bakterii.
[TOC]
Charakterystyka
Hemoolisyna składa się z siedmiu podjednostek i gen, który ją koduje, ma siedem promotorów. Te siedem podjednostek jest wstawianych do błony plazmatycznej białych krwinek, a gdy razem tworzą kanał jonowy, w którym metabolity wnętrza komórki uciekają.
Hemoolisyna jest zależną od wapnia cytotoksyna (Ca+2) pozakomórkowa, która działa na błonę plazmatyczną krwionośnych komórek potoku. Pory tworzące w błonie są również hydrofilowe i powodują wejście wody do wnętrza komórki, co może powodować lizę.
Może ci służyć: Unaporto: transport przez błony, cechyHemoolisiny są produktami białkowymi typowymi dla bakterii typu Gram-ujemnych i wszystkie mają dwie cechy:
Oku. Hemoolisine Nonapapéptides znajdują się w pobliżu C-końcowej części pierwotnej struktury białka.
2- Wszystkie hemoolisiny są wydzielane przez bakterię do pożywki pozakomórkowej przez transporter typu ABC (z kasety wiążących ATP English).
Hemoolisiny jest zwykle wykrywane w szczepach bakteryjnych poprzez wzrost w środku agaru krwi. W teście obserwuje się hemolityczne halo, produkt pęknięcia czerwonych krwinek w pobliżu kolonii bakterii.
Chłopaki
Istnieje kilka różnych rodzajów hemoolisin, są one klasyfikowane z greckim literą na początku ich imienia. Najczęściej badane i powszechne to hemoolisiny α, β i γ, wszystkie wytwarzane przez szczep Staphylococcus aureus.
Typy hemoolisiny są klasyfikowane zgodnie z zakresem komórek, które atakują i zgodnie z ich pierwotną strukturą białka.
α-hemolzyna
To białko jest typowe dla szczepów Staphylococcus aureus I Escherichia coli; atakuje neutrofile, czerwone krwinki, limfocyty, makrofagi, dorosłe i embrionalne fibroblasty. Oddziałują z głowicami polarnymi lipidów błony plazmatycznej tych komórek, aż do internalizowania hydrofobowego ogona około 5 ӑ wewnątrz błony.
β-hemolzyna
Wyprodukowane przez Staphylococcus aureus Do mniejszej proporcji niż α-hemolzyna, β-hemolzyna atakuje głównie erytrocyty i jest wewnętrzna w błonie wyłącznie przez bogate domeny w sfingomii błony komórkowej.
γ-hemolzyna
Zostało to również zaobserwowane Staphylococcus aureus. Został sklasyfikowany jako białko hemolityczne i leukotoksyna w tym samym czasie, ponieważ wpływa na polimorfonuklearne komórki ludzi, monocytów, makrofagów i rzadko, nawet na czerwone komórki krwi.
Ten rodzaj γ-hemolisyny jest jednym z najmniej scharakteryzowanych, dlatego znaczna część jej mechanizmu działania została nieznana i nie została zbadana In vivo.
Może ci służyć: osteoblasty: trening, cechy, funkcje, patologieMechanizmy działania
Mechanizm działania, który został wyjaśniony stosunkowo jasny, jest α-hemolisyna. Ponieważ jednak wszystkie są białkami hemolitycznymi, uważa się, że większość procesów jest powszechna dla wszystkich hemolizyny.
Naukowcy sugerują, że w przypadku bakterii segregują hemoolisynę do środowiska, muszą być w mikrośrodowisku odżywczym, dlatego byłby to mechanizm, który wywołuje komórkę do niszczenia białych komórek i uzyskania ich składników odżywczych.
Mechanizm został opisany w trzech etapach: Unii do błony komórkowej, insercji i oligomeryzacji.
Związek błony
Stwierdzono, że hemoolisiny mogą łączyć integryny neutrofili, a w erytrocytach zaobserwowano, że białka te wiążą się z glikozylowanymi składnikami, takimi jak glikoproteiny, zwoje i gliforyny błony komórkowej.
Niektórzy autorzy sugerują, że obecność receptorów w błonie nie jest niezbędna dla związku hemolizyny. W każdym razie mechanizm rekonnetu białka komórkowego nie jest jeszcze znany dokładnie.
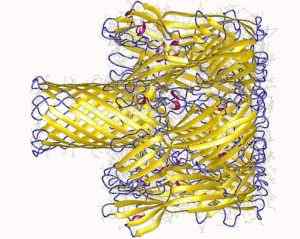 Pory transbranowe utworzone przez białko hemoolisyny Staphylococcus (Źródło: Autorzy osadzania: piosenka, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, godz., Gouaux, J.I.; Autor wizualizacji: Użytkownik: AstroJan [CC do 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] przez Wikimedia Commons)
Pory transbranowe utworzone przez białko hemoolisyny Staphylococcus (Źródło: Autorzy osadzania: piosenka, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, godz., Gouaux, J.I.; Autor wizualizacji: Użytkownik: AstroJan [CC do 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] przez Wikimedia Commons) Interakcja z membraną występuje w dwóch etapach:
- Początkowe związek (odwracalny): Gdy hemoolisina wiąże się z domenami złącza wapniowego błony. Ten krok występuje na powierzchni i jest bardzo podatny na rozładowania elektrostatyczne.
- Nieodwracalny związek: Zarezerwuj domeny aminokwasowe z składnikami lipidowymi zewnętrznej warstwy błony plazmatycznej białych krwinek, aby utworzyć fizyczne związki między związkami hydrofobowymi błony.
Może ci służyć: ściana komórkowaWstawienie toksyny do błony
Α-hemolzyna wkłada odpady 177 i 411 w pierwszej lipidowej monowarstce. W pożywce pozakomórkowej hemoolisyna jest związana z jonami wapnia, które indukują w tym układ strukturalny i przyczynia się do jego aktywacji.
To insercja konsoliduje nieodwracalny związek błony komórkowej. Po wystąpieniu układu hemoolisyn staje się integralnym białkiem, ponieważ eksperymentalnie wykazano, że jedynym sposobem wyodrębnienia go z błony jest użycie detergentów, takich jak Triton X-100.
Oligomeryzacja
Gdy cała hemoolisina została włożona do błony plazmatycznej białej komórki.
Zaobserwowano, że proces oligomeryzacji jest faworyzowany przez mikrodominium lub balsas lipidów błony komórkowej. Regiony te nie mogą sprzyjać Związkowi Białka, ale faworyzują jego oligomeryzację po włożeniu.
Im więcej hemoolisin wiąże się z błoną, tym większa zostanie utworzona ilość porów. Ponadto hemoolisiny mogą oligomeryzować ze sobą (sąsiadujące) i tworzyć znacznie większe kanały.
Bibliografia
- Bakás, L., Ostolaza, godz., Vaz, w. L., & Goñi, F. M. (1996). Odwracalna adsorpcja i nieodwracalne wstawienie Escherichia coli alfa-hemolizyna do dwuwarstw lipidowych. Biophysical Journal, 71 (4), 1869-1876.
- Dalla Serra, m., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,… & Prévot, g. (2005). Staphylococcus aureus bicomponent γ-hemolizyny, HLGA, HLGB i HLGC, mogą mieszać się do zliczania wszystkich składników. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, J. DO., I Robinson, J. (1969). Właściwości oczyszczonej gronkowca β-hemolizyny. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike i., Hashimoto, h., & Clewell, D. B. (1984). Hemolizyna z streptococcus faecalis subsecies zymogenes, które przyczyniasz się do wirulencji u myszy. Infekcja i odporność, 45 (2), 528-530.
- Remington, J. S., Klein, J. ALBO., Wilson, c. B., Nizet, v., & Maldonado i. DO. (Eds.). (1976). Zakaźne pustynie płodu i noworodka (vol. 4). Philadelphia: Saunders.
- Todd, e. W. (1932). Antygenowa hemolizyna paciorkowca. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pochodzenie Pietraina, cechy, jedzenie, reprodukcja
- Charakterystyka zastawek, histologia, funkcje »

